Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
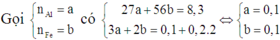
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO
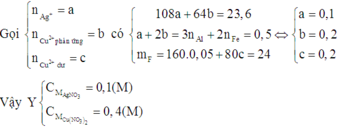

Đáp án D
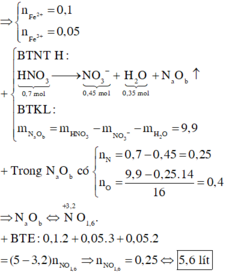
Trong phản ứng của Fe với dung dịch X, chất khử là Fe, chất oxi hóa là NO 3 - / H + , Fe3+ và Cu2+. Sau phản ứng thu được hỗn hợp kim loại, chứng tỏ Fe dư nên muối tạo thành trong dung dịch là Fe2+.
Áp dụng bảo toàn electron trong phản ứng của Fe với dung dịch X, bảo toàn điện tích trong dung dịch Y và bảo toàn nguyên tố Fe, N, ta có :
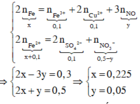
Theo bảo toàn khối lượng, ta có :

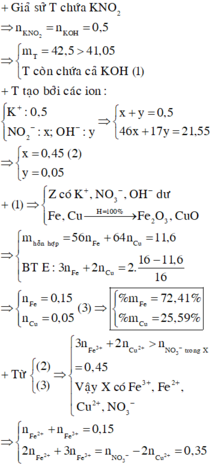

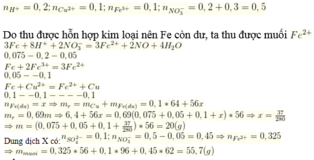

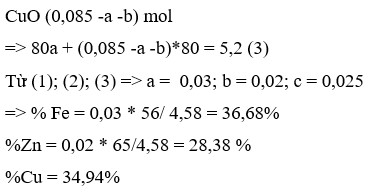
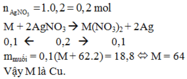
a, \(n_{HCl}=0,1.0,1=0,01\left(mol\right)\)
\(m_{ddHCl}=100.1,05=105\left(g\right)\)
BTNT H, có: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,005\left(mol\right)\)
Theo ĐLBT KL, có: mM + m dd HCl = m dd sau pư + mH2
⇒ mM = 105,11 + 0,005.2 - 105 = 0,12 (g) = m
Giả sử M có hóa trị n.
BT e, có: n.nM = 2nH2 \(\Rightarrow n_M=\dfrac{2n_{H_2}}{n}=\dfrac{0,01}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{0,12}{\dfrac{0,01}{n}}=12n\left(g/mol\right)\)
Với n = 2, MM = 24 (g/mol) là thỏa mãn.
Vậy: M là Mg.
b, Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{0,26}{65}=0,004\left(mol\right)\\n_{Fe}=\dfrac{0,28}{56}=0,005\left(mol\right)\end{matrix}\right.\)
\(n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,004_____0,008__0,004 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,005____0,01____0,005 (mol)
⇒ nHCl (dư) = 0,02 - 0,008 - 0,01 = 0,002 (mol)
Sau pư trong dd còn: \(\left\{{}\begin{matrix}ZnCl_2:0,004\left(mol\right)\\FeCl_2:0,005\left(mol\right)\\HCl:0,002\left(mol\right)\end{matrix}\right.\)
- Cho Mg vào đến khi thu dd có chứa 2 muối (MgCl2 và ZnCl2):
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
__0,001______0,002 (mol)
\(Mg+FeCl_2\rightarrow MgCl_2+Fe\)
0,005_____0,005___________0,005 (mol)
\(Mg+ZnCl_2\rightarrow MgCl_2+Zn\)
x_________x_______________x (mol)
B gồm: 0,005 (mol) Fe và x (mol) Zn
Mà: mB - mMg = 0,218
⇒ 0,005.56 + 65x - (0,001 + 0,005 + x).24 = 0,218
⇒ x = 0,002 (mol)
⇒ mMg pư = (0,001 + 0,005 + 0,002).24 = 0,192 (g)
ai giúp mình với ạ