Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
- A sai vì Cu(OH)2 không tan
- B sai vì Al(OH)3,Mg(OH)2 không tan
- D sai vì Zn(OH)2,Cu(OH)2 không tan

a, Không pư
b, \(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
c, Không pư.
d, \(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)

Câu 2:
Pt: Mg(OH)2 --to--> MgO + H2O
.....2Fe(OH)3 --to--> Fe2O3 + 3H2O
.....2Al(OH)3 --to--> Al2O3 + 3H2O
1. đề sai
2.
Mg(OH)2 → MgO + H2O
2Al(OH)3 → Al2O3 + 3H2O
2Fe(OH)3 → Fe2O3 + 3H2O

$n_{Ba} = n_{Ba(OH)_2} = 0,12(mol)$
$n_{H_2} = \dfrac{1,12}{22,4} = 0,05(mol)$
Gọi $n_{Na} = a ; n_O = b$
Ta có :
$23a + 16b + 0,12.137 = 21,1$
Bảo toàn electron : $a + 0,12.2 = 2b + 0,05.2$
Suy ra $a = \dfrac{177}{1550} ; b = \dfrac{197}{1550}$
Suy ra $m_{NaOH} = \dfrac{177}{1550}.40 = 4,57(gam)$

a) PTHH : \(FeO+H_2-t^o->Fe+H_2O\)
\(CuO+H_2-t^o->Cu+H_2O\)
Đặt \(\hept{\begin{cases}n_{FeO}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{cases}}\) => \(72x+80y=11,2\left(I\right)\)
Có : \(m_{O\left(lấy.đi\right)}=m_{giảm}=1,92\left(g\right)\)
=> \(n_{O\left(lấy.đi\right)}=\frac{1,92}{16}=0,12\left(mol\right)\) Vì H% = 80% => Thực tế : \(n_{O\left(hh\right)}=\frac{0,12}{80}\cdot100=0,15\left(mol\right)\)
BT Oxi : \(x+y=0,15\left(II\right)\)
Từ (I) và (II) suy ra : \(\hept{\begin{cases}x=0,1\\y=0,05\end{cases}}\)
=> \(\hept{\begin{cases}m_{FeO}=7,2\left(g\right)\\m_{CuO}=4\left(g\right)\end{cases}}\)
b) PTHH : \(Fe+H_2SO_4-->FeSO_4+H_2\)
BT Fe : \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
Theo pthh : \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
=> \(V_{H_2}=2,24\left(l\right)\)
BT Cu : \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{CR\left(ko.tan\right)}=0,05\cdot64=3,2\left(g\right)\)

$1)$
$PTHH:Ca(OH)_2+2HCl\to CaCl_2+2H_2O$
$n_{Ca(OH)_2}=\dfrac{14,8}{74}=0,2(mol)$
$n_{HCl}={10,95}{36,5}=0,3(mol)$
Lập tỉ lệ: $\dfrac{n_{Ca(OH)_2}}{1}>\dfrac{n_{HCl}}{2}\Rightarrow Ca(OH)_2$ dư
$\Rightarrow n_{Ca(OH)_2(dư)}=0,2-\dfrac{1}{2}.0,3=0,05(mol)$
Theo PT: $n_{CaCl_2}=\dfrac{1}{2}n_{HCl}=0,15(mol)$
$\Rightarrow m_{CaCl_2}=0,15.111=16,65(g)$
$m_{Ca(OH)_2(dư)}=0,05.74=3,7(g)$
$2)$
$a)PTHH:Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\uparrow$
$b)n_{Fe}=\dfrac{22,4}{56}=0,4(mol)$
Theo PT: $n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,2(mol)$
$n_{CO}=\dfrac{3}{2}n_{Fe}=0,6(mol)$
$\Rightarrow m_{Fe_2O_3}=0,2.160=32(g)$
$V_{CO}=0,6.22,4=13,44(lít)$
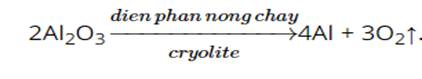
Câu 1. Trong các khí sau khí nào nặng hơn khí O2?
A. Khí methane (CH4). B. Khí carbon dioxide (CO2).
C. Khí Helium (He). D.Khí Hydrogen (H2).
Câu 2. Câu khẳng định nào sau đây là đúng?
A. Hiệu suất phản ứng cho biết mức độ của phản ứng xảy ra ở điều kiện thực tế.
B. Hiệu suất phản ứng cho biết mức độ của phản ứng xảy.
C. Hiệu suất phản ứng xảy ra ở điều kiện thực tế.
D. Hiệu suất phản ứng luôn không vượt qua 80%.
Câu 3. Tính độ tan của K2CO3 trong nước ở 20°C. Biết rằng ở nhiệt độ này hòa tan hết 45 gam muối trong 150 gam nước thì dung dịch bão hòa.
A. 20 gam. B. 12 gam. C. 45 gam. D. 30 gam.
Câu 4. Dãy các bazơ tan trong nước gồm:
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Mg(OH)2. B. Cu(OH)2; Zn(OH)2; Al(OH)3; NaOH.
C. NaOH; Ca(OH)2; KOH; Ba(OH)2. D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2.
Câu 5. Dung dịch là:
A. hỗn hợp gồm dung môi và chất tan.
B. hợp chất gồm dung môi và chất tan.
C. hỗn hợp đồng nhất gồm nước và chất tan.
D. hỗn hợp đồng nhất gồm dung môi và chất tan.
Câu 6. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Cân bằng hoá học.
C. Phản ứng một chiều.
D. Phản ứng thuận nghịch.
Câu 7: Acid là phân tử khi tan trong nước phân li ra
A. OH-. B. H+. C. Ca2+. D. Cl-.
Câu 8: Base là phân tử khi tan trong nước phân li ra
A. OH-. B. H+. C. Ca2+. D. Cl-.
Câu 9: (VD) Cho 8,45g Zinc (Zn) tác dụng với 5,9496 lít chlorine (Cl2) ở điều kiện chuẩn. Hỏi chất nào sau phản ứng còn dư?
A. Zn dư. C. Phản ứng không xảy ra
B. Cl2 dư.. D. Phản ứng vừa đủ, không có chất dư.
Câu 10. Phản ứng tỏa nhiệt là phản ứng
A. khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng.
B. khi xảy ra kèm theo sự giải phóng nhiệt chất phản ứng ra môi trường.
C. khi xảy ra kèm theo sự trao đổi nhiệt giữa các chất phản ứng với các chất trong môi trường.
D. khi xảy ra kèm theo sự trao đổi nhiệt giữa các chất phản ứng.
Câu 11. Thể tích của 0,5 mol khí CO2 ở điều kiện chuẩn là
A. 11,55 (lít). B. 11,2 (lít). C. 10,95 (lít) D. 12,395 (lít).
Câu 12. Đốt cháy 1,2 gam carbon cần a gam oxygen, thu được 4,4 gam khí carbondioxide. Tính a.
A. 3,8. B. 2,2. C. 3,2. D. 4,2.
A. TỰ LUẬN:
Câu 17. Định nghĩa độ tan của một chất trong nước, nồng độ phần trăm, nồng độ mol của dung dịch.
Độ tan (ký hiệu là S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Nồng độ phần trăm của dung dịch (kí hiệu là C%) cho ta biết số gam chất tan có trong 100 gam dung dịch.
Nồng độ mol của dung dịch (kí hiệu là CM) cho ta biết số mol chất tan có trong 1 lít dung dịch.
Câu 18. Biết khái niện và tính chất của acid và base.
acid là chất phân ly trong dung dịch nước tạo thành H+ (ion hydro hoặc là proton) còn base là chất phân ly trong dung dịch nước tạo thành OH− (ion hydroxide).
Câu 19: Dạng bài tập hoàn thành các phương trình còn thiếu
Ví dụ: Hoàn thành các phương trình còn thiếu theo sơ đồ sau:
2HCl + 2Al(OH)3 → \(2AlCl_3\) + 4H2O
H2SO4 + 2\(KOH\) → K2SO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + \(2H_2O\)
H2CO3 + \(Ca\left(OH\right)_2\) → CaCO3 + 2 H2O
Câu 20: Dạng bài tập tính theo phương trình hóa học …
Ví dụ 1: Cho 13 gam Zn vào hydrochloric acid (HCl) dư.
a) Viết phương trình hóa học.
b) Tính khối lượng muối thu được đã dùng?
c) Tính khối lượng của HCl dư khi cho 100g dung dịch HCl 18,25% vào 13g Zn trên.
\(n_{Zn}=\dfrac{13}{65}=0,2mol\\ a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{ZnCl_2}=0,2.136=27,2g\\ c.n_{HCl}=\dfrac{18,25\%.100}{100\%.36.5}=0,5mol\\ n_{HCl.pư}=2n_{Zn}=0,4mol\\ m_{HCl.dư}=\left(0,5-0,4\right).36,5=3,65g\)
Ví dụ 2: Trong công nghiệp aluminium (Al) được sản xuất từ aluminium oxide (Al2O3) theo phương trình hóa học:
Một loại quặng boxide có chứa 85% là Al2O3. Hãy tính khối lượng aluminium (Al) được tạo thành từ 2 tấn quặng boxide, biết hiệu suất của quá trình sản xuất là 90%.
\(m_{Al_2O_3}=2.85\%=1,7tấn\\ \dfrac{m_{Al_2O_3}}{102}:2=\dfrac{m_{Al\left(LT\right)}}{27}:4\\ \Leftrightarrow\dfrac{1,7}{102}:2=\dfrac{m_{Al\left(LT\right)}}{27}:4\\ \Leftrightarrow m_{Al\left(LT\right)}=0,9tấn\\ m_{Al\left(TT\right)}=0,9.90\%=0,81tấn\)