Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)


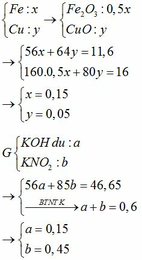
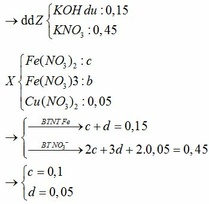

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a_____a (mol)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b_____3b_______b_____\(\dfrac{3}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27b=36,1\\a+\dfrac{3}{2}b=\dfrac{21,28}{22,4}=0,95\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,5\\b=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,5\cdot56=28\left(g\right)\\m_{Al}=8,1\left(g\right)\end{matrix}\right.\)
b+c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{HCl}=2a+3b=1,9\left(mol\right)\\n_{FeCl_2}=0,5\left(mol\right)\\n_{AlCl_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{HCl}}=\dfrac{1,9}{0,2}=9,5\left(M\right)\\C_{M_{FeCl_2}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g
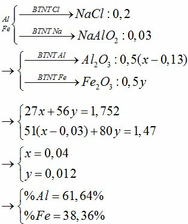






a) Vì Cu không tác dụng với HCl nên => chất rắn không tan là Cu , mCu = 0,6(g)
=> %mCu = \(\dfrac{0,6}{2,25}.100\%=26,67\%\)
mAl + mFe = 2,25 - 0,6 = 1,65 (g)
Gọi x ,y lần lượt là số mol của Al và Fe
Ta có PTHH :
\(\left(1\right)2Al+6HCl->2AlCl3+3H2\uparrow\)
x mol......... 3xmol....... xmol......... 3/2x mol
\(\left(2\right)Fe+2HCl->FeCl2+H2\uparrow\)
y mol...... 2ymol........ ymol........ ymol
Ta có PT : \(\left\{{}\begin{matrix}27x+56y=1,65\\\dfrac{3}{2}x+y=\dfrac{1344}{22,4.1000}\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}x=0,03\\y=0,015\end{matrix}\right.=>\left\{{}\begin{matrix}nAl=0,03\left(mol\right)\\nFe=0,015\left(mol\right)\end{matrix}\right.=>\left\{{}\begin{matrix}\%mAl=\dfrac{0,03.27}{2,25}.100\%=36\%\\\%mFe=\dfrac{0,015.56}{2,25}.100\%=37,33\%\end{matrix}\right.\)
a) PT phản ứng:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Cu+HCl\rightarrow\) không phản ứng
=> 0,6gam chất rắn còn lại là Cu.
Gọi x, y lần lượt là số mol Al,Fe.
Ta có :
\(3x+2y=2\times0,06=0,12\)
\(27x+56y=2,25-0,6=1,65\)
=> x = 0,03(mol) ; y = 0,015(mol)
=> %Cu = \(\dfrac{0,06}{2,25}.100\%=26,67\%\)
\(\%Fe=\dfrac{56.0,015\%}{2,25}.100\%=37,33\%\)
%Al = 36%