Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho h2 gồm CuO và Fe2O3 vào dd axit clohiđric HCl có pthh:
CuO + 2HCl -> CuCl2 + H2O (1)
Fe2O3 + 6HCL -> 2FeCl3 + 3H2O (2)
*Đổi: 200ml = 0,2 l
Theo bài ra ta có:
nHCl = CM . V = 3,5 . 0,2 = 0,7 mol
Gọi a, b lần lượt là số mol của CuO và Fe2O3
=> mCuO = a . MCuO = 80a
mFe2O3 = b . MFe2O3 = 160b
=> mhh = mCuO + mFe2O3 = 80a + 160b (I)
Theo pthh (1)(2) ta có:
nHCl(pt1) = 2. nCuO = 2a mol
nHCl(pt2) = 6. nFe2O3 = 6b mol
=> nHCl(tgpư) = nHCl(bđ) = nHCl(pt1) + nHCl(pt2)
⇔ 0,7 = 2a + 6b (II)
Từ (I) (II) ta có hệ phương trình
+) 80a + 160b = 20
+) 2a + 6b = 0,7
=> a = 0,05 ; b = 0,1
=> nCuO = a = 0,05 mol
nFe2O3 = b = 0,1 mol
=> mCuO = nCuO .MCuO = 0,05 . 80 = 4 g
=> mFe2O3 = mhh - mCuO = 20 - 4 = 16 g
Vậy...

a) PTHH
\(2HCl+CuO\rightarrow CuCl_2+H_2O\)
\(6HCl+Fe_2O_3\rightarrow2FeCl_3+3H_2O\)
b ) \(n_{HCl}=3,5\times0,2=0,7\left(mol\right)\)
Gọi số mol của \(CuO;Fe_2O_3\) lần lượt là x và y ( x ; y > 0 )
Ta có hệ \(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{CuO}=80\times0,05=4\left(g\right);m_{Fe_2O_3}=160\times0,1=16\left(g\right)\)

B1:
Ba(OH)2 + 2HCl -> BaCl2 + 2H2O
Theo bài ra ta có:
nBa(OH)2 bđ = 0,2 . 1 = 0,2 mol
nHCl bđ = 0,3 . 2 = 0,6 mol
Theo pthh ta có:
nBa(OH)2 pt= 1 mol
nHCl pt = 2 mol
Ta có tỉ lệ:
\(\dfrac{nBa\left(OH\right)_2bđ}{nBa\left(OH\right)_2pt}\)=\(\dfrac{0,2}{1}\)= 0,2 < \(\dfrac{nHCl_{bđ}}{nHCl_{pt}}\)= \(\dfrac{0,6}{2}\)= 0,3
=> Sau pư Ba(OH)2 tgpư hết ; HCl còn dư
dd thu đc sau pư: BaCl2 và HCl dư
Theo pthh và bài ta có:
nBaCl2 = nBa(OH)2 = 0,2 mol
V dd sau pư = 0,2 + 0,3 = 0,5 l
=>CM dd BaCl2 = 0,2/0,5 = 0,4 M
nHCl tgpư = nBa(OH)2 = 0,2 mol
=> nHCl dư = 0,6 - 0,2 = 0,4 mol
Vdd HCl dư = 0,4 / 0,5 = 0,8M
Vậy...

CuO +2HCl------> CuCl2 +H2O(1)
x--------2x-------------x---------x
Fe2O3 +6HCl------>2FeCl3+ 3H2O(2)
y----------6y--------------2y-------3y
Gọi n\(_{CuO}=x\Rightarrow m_{CuO}=80x\)
n\(_{Fe2O3}=y\Rightarrow m_{Fe2O3}=160y\)
Theo bài ra ta có
\(80x+160y=20\left(\cdot\right)\)
Mặt khác
n\(_{HCl}=0,2.3,5=0,7\left(mol\right)\)
Theo pthh 1 và 2 ta có
2x+6y=0,7\(\left(\cdot\cdot\right)\)
Từ \(\left(\cdot\right)và\left(\cdot\cdot\right)\) ta có hệ pt
\(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
m\(_{CuO}=0,05.80=4\left(g\right)\)
m\(_{Fe2O3}=20-4=16\left(g\right)\)
Chúc bạn học tốt

a) 2HCl + CuO ----> CuCl2 + H2O
6HCl + Fe2O3 ----> 2FeCl3 + 3H2O
b) nHCl= 3.5 x 0.2 = 0.7
Đặt x, y lần lượt là số mọl của HCl ở pt 1, pt2
2HCl + CuO ----> CuCl2 + H2O
2x-------------x-----------x--------- x
6HCl + Fe2O3-----> 2FeCl3 + 3H2O
6y---------------y----------------2y--... 3y
ta có hệ phương trình hai ẩn x, y
2x+ 6y = 0.7
80x+160y=20
===> x=0.05;y = 0.1
m CuO= 0.05 x 80=4 g
m Fe2O3= 0.1 x 160 =16 g
sao câu trả lời của bạn giống trên Yahho vậy bạn chép trên đó hả

Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
a) CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:
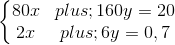
Giải phương trình (1) (2) ta được x = 0,05 mol; y = 0,1 mol
b) mCuO = 0,05 . 160 = 4 g
m Fe2O3 = 20 – 4 = 16 g
\(2HCl+CuO\rightarrow CuCl_2+H_2O \)
2 : 1 : 1 : 1
2x \(\leftarrow\)80x
\(6HCl+Fe_2O_3\rightarrow2FeCl_3+3H_2O\)
6 : 1 : 2 : 3
6y \(\leftarrow\)160y
\(n_{HCl}=3,5.0,2=0,7\left(mol\right)\)
gọi \(n_{CuO}\)là x còn \(n_{Fe_2O_3}\)là y
suy ra \(m_{CuO}=80x\),\(m_{Fe_2O_3}\)=160y
ta có: 80x+160y=20g
x+y =0,7mol
\(\Rightarrow x=0,05,y=0,1\)
\(\Rightarrow m_{CuO}=0,05.80=4\left(g\right)\)
\(m_{Fe_2O_3}=0,1.160=16\left(g\right)\)

Gọi a là số mol của CuO và b là số mol của Fe2O3 có trong 20 gam hh
200 ml dd HCl 3,5 M => 0,7 mol HCl
CuO + 2HCl ---> CuCl2 + H2o
a mol -->2a mol
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
b mol ----->6b mol
Ta có hệ PT:
80a + 160b = 20
2a + 6b = 0,7
Giải hệ trên ta được
a = 0,05 mol
b = 0,1 mol
=> khối lượng CuO trong hỗn hợp là 4 gam
=> %CuO = 20%
=> %Fe2O3 = 80%

CuO + 2HCl → CuCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
\(n_{HCl}=0,2\times3,5=0,7\left(mol\right)\)
a) Gọi x,y lần lượt là số mol của CuO và Fe2O3
Ta có: \(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
Vậy \(n_{CuO}=0,05\left(mol\right)\Rightarrow m_{CuO}=0,05\times80=4\left(g\right)\)
\(n_{Fe_2O_3}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\%m_{CuO}=\frac{4}{20}\times100\%=20\%\)
\(\%m_{Fe_2O_3}=100\%-20\%=80\%\)
b) Theo pT1: \(n_{CuCl_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{CuCl_2}=0,05\times135=6,75\left(g\right)\)
Theo pT2: \(n_{FeCl_3}=2n_{Fe_2O_3}=2\times0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=0,2\times162,5=32,5\left(g\right)\)
\(m_{muối}=32,5+6,75=39,25\left(g\right)\)
gọi a, b lần lượt là số mol của CuO và Fe2O3 có trong hỗn hợp
PTPU
CuO+ 2HCl\(\rightarrow\) CuCl2+ H2O
..a.........2a............a................ ( mol)
Fe2O3+ 6HCl\(\rightarrow\) 2FeCl3+ 3H2O
..b............6b...........2b................. ( mol)
có: nHCl= 0,2. 3,5= 0,7( mol)
ta có hệ pt:
\(\left\{{}\begin{matrix}80a+160b=20\\2a+6b=0,7\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\) %mCuO= \(\frac{0,05.80}{20}\). 100%= 20%
%mFe2O3= 100%- 20%= 80%
theo các PTPU có:
nCuCl2= nCuO= 0,05( mol)
nFeCl3= 2nFe2O3= 0,2( mol)
\(\Rightarrow\) mCuCl2= 0,05. 135= 6,75( g)
mFeCl3= 0,2. 162,5= 32,5( g)

Đổi 200ml = 0,2 lít
Ta có: \(n_{HCl}=3,5.0,2=0,7\left(mol\right)\)
Gọi x, y lần lượt là số mol của CuO và Fe2O3
PTHH:
CuO + 2HCl ----> CuCl2 + H2O (1)
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O (2)
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=6.n_{Fe_2O_3}=6y\left(mol\right)\)
=> 2x + 6y = 0,7 (*)
Theo đề, ta có: 80x + 160y = 20 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+6y=0,7\\80x+160y=20\end{matrix}\right.\)
=> x = 0,05, y = 0,1
=> \(m_{CuO}=80.0,05=4\left(g\right)\)
\(m_{Fe_2O_3}=20-4=16\left(g\right)\)
đổi 200ml = 0.2 l
nhcl = 0.2*3.5 = 0.7 ( mol)
gọi số mol của CuO là x
số mol của Fe2O3 là y
PTHH:
CuO + 2HCl ➜ CuCl2 + H2O
x 2x
Fe2O3 + 6HCl ➜ 2FeCl3 + 3H2O
y 6y
ta có hệ phương trình
\(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\)
⇒ x= 0.05
y=0.1
mCuO= 0.05*80=4 (g)
mFe2O3= 0.1*160=16(g)

a)
CuO + 2HCl ---> CuCl2 + H2O
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
b)
nHCl= 3.5 x 0.2 = 0.7
Đặt x, y lần lượt là số mọl của HCl ở pt 1, pt2
2HCl + CuO ----> CuCl2 + H2O
2x-------------x-----------x--------- x
6HCl + Fe2O3-----> 2FeCl3 + 3H2O
6y---------------y----------------2y--... 3y
ta có hệ phương trình hai ẩn x, y
2x+ 6y = 0.7
80x+160y=20
===> x=0.05;y = 0.1
m CuO= 0.05 x 80=4 g
m Fe2O3= 0.1 x 160 =16 g
Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
a) CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:
80x+160y=20
2x+6y=0,7
Giải phương trình (1) (2) ta được x = 0,05 mol; y = 0,1 mol
b) mCuO = 0,05 . 160 = 4 g
m Fe2O3 = 20 – 4 = 16 g