Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNa2O=15,5/62=0,25(mol)
a) PTHH: Na2O + H2O -> 2 NaOH
nNaOH= 2.0,25=0,5(mol)
=> CMddNaOH=0,5/0,5=1(M)
b) 2 NaOH + H2SO4 -> Na2SO4 + 2 H2O
0,5__________0,25____0,25(mol)
mH2SO4=0,25.98=24,5(g)
c) mddH2SO4=24,5/20%= 122,5(g)
=>VddH2SO4= 122,5/1,14= 107,456(ml)
=> Vddsau= 0,5+ 0,107456=0,607456(l)
CMddNa2SO4= 0,25/0,607456=0,412(M)
Số mol của natri oxit
nNa2O = \(\dfrac{m_{Na2O}}{M_{Na2O}}=\dfrac{15,5}{62}=0,25\left(mol\right)\)
Pt : Na2O + H2O → 2NaOH\(|\)
1 1 2
0,25 0,5
a) Số mol của dung dịch natri hidroxit
nNaOH = \(\dfrac{0,15.2}{1}=0,5\left(mol\right)\)
Nồng độ mol của dung dịch natri hidroxit
CMNaOH = \(\dfrac{n}{V}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O\(|\)
1 2 1 2
0,25 0,5 0,25
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,25 . 98
= 24,5 (g)
Khối lượng của dung dịch axit sunfuric cần dùng
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{24,5.100}{20}=122,5\) (g)
c) Thể tích của dung dịch axit sunfuric
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{122,5}{1,14}=107,45\left(ml\right)\)
Số mol của natri sunfat
nNa2SO4 = \(\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
Nồng độ mol của natri sunfat
CMNa2SO4 = \(\dfrac{n}{V}=\dfrac{0,25}{107,45}=0,002\left(M\right)\)
Chúc bạn học tốt

nH2 = 85,12 : 22,4 = 3,8 (mol) ; nH2O = VH2O.D = 108 (g) => nH2O = 108/18 = 6 (mol)
PTHH:
2Na + 2C2H5OH → 2C2H5ONa + H2↑
x → 0,5x (mol)
2Na + 2H2O → 2NaOH + H2↑
6 → 3 (mol)
Ta có: nH2 = 0,5x + 3 = 3,8
=> x = 1,6 (mol) = nC2H5OH
mC2H5OH = 1,6.46 = 73,6 (g)
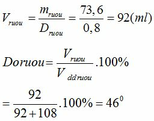

\(n_{AgNO_3}=\dfrac{34}{170}=0,2\left(mol\right)\)
\(C_{M_{ddAgNO_3}}=\dfrac{0,2}{0,1}=2M\)
\(n_{AgNO_3}=\dfrac{34}{170}=0,2\left(mol\right)\\ V_{ddAgNO_3}=100\left(ml\right)=0,1\left(l\right)\\ C_{MddAgNO_3}=\dfrac{0,2}{0,1}=2\left(M\right)\)

\(C\%_{sau}=0,2=\dfrac{100.1,84.0,98}{100.1,84+V_{H_2O}}\\ V_{H_2O}=717,6mL\)

\(n_{MgCl_2}=\dfrac{9,5}{95}=0,1\left(mol\right)\\ PTHH:MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\\ \Rightarrow n_{Mg\left(OH\right)_2}=n_{MaCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{Mg\left(OH\right)_2}=0,1\cdot58=5,8\left(g\right)\)
Vậy ko có đáp án nào đúng
\(Na_2O+H_2O->2NaOH\\ n_{NaOH}=2\cdot\dfrac{5,6}{52}=0,18mol\\ C_M=\dfrac{0,18}{3}=0,06M\\ 0,06=\dfrac{10\cdot1,2\cdot C\%}{40}\\ C\%=20\%\)
bạn ơi đc r sao kêu bồ ơi=))