Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
Fe + 2HCl → Fe Cl 2 + H 2
Fe + H 2 SO 4 → FeSO 4 + H 2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
n FeCl 2 = 19,05/127 = 0,15 mol = n Fe
m FeSO 4 = 0,15 x 152 = 22,8g

Câu 1
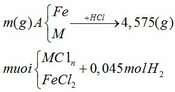
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
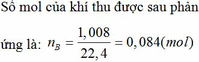
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
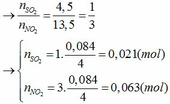
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
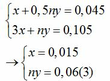
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

vì 3 chất trên đều tác dụng với HCl hóa trị II nên gọi M là nguyên tổ kim loại trung bình của hỗn hợp
ta có: M+2HCl−−>MCl2+H2M+2HCl−−>MCl2+H2
theo PT trên ta thấy: nHCl=2nH2=2∗(6.72/22.4)=0.6molnHCl=2nH2=2∗(6.72/22.4)=0.6mol
áp dụng định luật bảo toàn khối lượng ta có
m muối tạo thành = m hỗn hợp + mHCl - mH2 = 14.7 + 0.6*36.5 - 0.3*2 =36 (g)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)
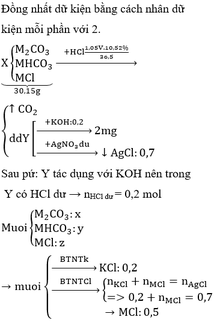
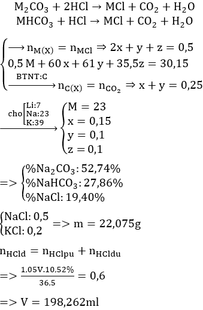

bài 2 :
Khi cho 1 mẫu sắt hòa tan hoàn toàn vào dd HCl thì muối thu được là FeCl2
=> mFeCl2=19,05(g) => nFeCl2=0,15(mol)
PTHH :(1)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 \(\uparrow\)
0,15mol..........0,15mol
=> mFe\(_{\left(m\text{ẫu}-1\right)}=0,15.56=8,4\left(g\right)\)
Vì 2 mẫu sắt có khối lượng bằng nhau nên Khi cho mẫu còn lại vào dd H2SO4 thì : Khối lượng của mẫu sắt 2 là :
mFe\(_{\left(m\text{ẫu}-2\right)}=mFe_{\left(m\text{ẫu}-1\right)}=8,4\left(g\right)\)
Khối lượng bằng nhau => nFe2=nFe1=0,15 mol
PTHH : (2)
Fe + H2SO4 \(\rightarrow\)\(\) FeSO4 + H2 \(\uparrow\)
0,15mol.............0,15mol
=> mFeSO4=0,15.152=22,8(g)
Vậy........