Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đề bài tóm tắt:
- Nguyên tử Fe có:
- Bán kính nguyên tử: \(r = 1 , 28 \textrm{ } \overset{\circ}{\text{A}} = 1 , 28 \times 10^{- 10} \textrm{ } \text{m}\)
- Khối lượng mol nguyên tử: \(M = 56 \textrm{ } \text{g}/\text{mol} = 0 , 056 \textrm{ } \text{kg}/\text{mol}\)
- Trong tinh thể: nguyên tử chiếm 74% thể tích.
- Tính khối lượng riêng của Fe trong tinh thể.
Bước 1: Khối lượng của 1 nguyên tử Fe
Số Avogadro: \(N_{A} = 6 , 022 \times 10^{23}\) nguyên tử/mol
\(m_{\text{Fe}} = \frac{M}{N_{A}} = \frac{0 , 056}{6 , 022 \times 10^{23}}\) \(m_{\text{Fe}} \approx 9 , 30 \times 10^{- 26} \textrm{ } \text{kg}\)
Bước 2: Thể tích hình cầu nguyên tử Fe
\(V_{\text{c} \overset{ˋ}{\hat{\text{a}}} \text{u}} = \frac{4}{3} \pi r^{3} = \frac{4}{3} \pi \left(\right. 1 , 28 \times 10^{- 10} \left.\right)^{3}\) \(V_{\text{c} \overset{ˋ}{\hat{\text{a}}} \text{u}} \approx 8 , 78 \times 10^{- 30} \textrm{ } \text{m}^{3}\)
Bước 3: Thể tích thực tế trong mạng tinh thể
Do các nguyên tử chỉ chiếm 74% thể tích:
\(V_{\text{th}ự\text{c}\&\text{nbsp};\text{t} \overset{ˊ}{\hat{\text{e}}}} = \frac{V_{\text{c} \overset{ˋ}{\hat{\text{a}}} \text{u}}}{0 , 74}\) \(V_{\text{th}ự\text{c}\&\text{nbsp};\text{t} \overset{ˊ}{\hat{\text{e}}}} \approx \frac{8 , 78 \times 10^{- 30}}{0 , 74} \approx 1 , 19 \times 10^{- 29} \textrm{ } \text{m}^{3}\)
Bước 4: Khối lượng riêng
\(\rho = \frac{m_{\text{Fe}}}{V_{\text{th}ự\text{c}\&\text{nbsp};\text{t} \overset{ˊ}{\hat{\text{e}}}}} = \frac{9 , 30 \times 10^{- 26}}{1 , 19 \times 10^{- 29}}\) \(\rho \approx 7 , 8 \times 10^{3} \textrm{ } \text{kg}/\text{m}^{3}\)
✅ Kết quả:
\(\boxed{\rho \approx 7 , 8 \textrm{ } \text{g}/\text{cm}^{3} = 7 , 8 \times 10^{3} \textrm{ } \text{kg}/\text{m}^{3}}\)
cho tui 1 tick nha

Gọi % đồng vị 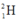 là a:
là a:
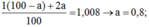

m của 1ml H2O: 1 gam
⇒ MH2O = 2. 1,008 + 16 = 18,016u
Khối lượng của 1 mol H2O là 18,016g.
Khối lượng của 1 mol H2O là 18,016g.
Số mol H2O =  mol
mol
⇒ số mol nguyên tử H = 2.nH2O = 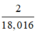 mol
mol
1 mol nguyên tử chứa 6,022.1023 nguyên tử
⇒ Số nguyên tử H trong 1ml H2O = 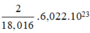
⇒ Số nguyên tử 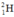 trong 1ml H2O =
trong 1ml H2O = 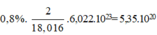 (nguyên tử)
(nguyên tử)

1 ml có khối lượng là 1 gam. Số mol H2O = 1/18 = 0,056 mol.
H2O ---> 2H + O
Nên số mol H = 2.0,056 = 0,112 mol. Số nguyên tử H là 0,112.6,023.1023 = 674576.1017.
Gọi a, b tương ứng là tỉ lệ % của 11H và 12H.
Ta có: a + 2b = 1,008 và a + b = 1 Suy ra b = 0,008 (0,8%); a = 0,992 (99,2%)
Như vậy, số nguyên tử 11H là 0,992.674576.1017 = 669179392.1014 nguyên tử. Số nguyên tử 12H là 0,008.674576.1017 = 5396608.1014 nguyên tử

Câu 1:
Tỉ số của e so với p là:
\(\dfrac{m_e}{m_p}=\dfrac{9,1094.10^{-31}}{1,6726.10^{-27}}=5,4463.10^{-4}\)
Tỉ số của e so với n là:
\(\dfrac{m_e}{m_n}=\dfrac{9,1094.10^{-31}}{1,6748.10^{-27}}=5,4391.10^{-4}\)
Câu 2:
a, tự làm nha
b, Ta có: \(1u=\dfrac{1}{12}.m_C=\dfrac{1}{12}.\dfrac{12}{6,022.10^{23}}\approx1,66.10^{-24}\left(g\right)\)
c, Vì \(1u=\dfrac{1}{12}.m_C\Rightarrow m_C=12u\)
d, Ta có: \(m_C=11,9059.m_H\Rightarrow m_H=\dfrac{12}{11,9059}=1,0079\left(u\right)\)