Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

VFeCl2 = 100 ml = 0,1 (l)
=> nFeCl2 = 0,1 . 1 = 0,1 mol
FeCl2 + 2NaOH->2 NaCl + Fe(OH)2 \(\downarrow\)
0,1----------------------------->0,1 mol
Fe(OH)2 \(^{to}\rightarrow\) FeO + H2O
0,1---------->0,1mol
FeO + CO \(^{to}\rightarrow\) Fe + CO2 \(\uparrow\)
0,1--------------->0,1mol
=> mFe = 0,1 . 56 = 5,6 g
vậy khối lượng KL màu trắng bạc (Fe) là 5,6 g



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

Gọi: M là NTK của R
a là số oxi hóa của R trong muối --> CTPT muối của R là R(2/a)CO3.
a) Từ nCO2 = n hỗn hợp = 0,5 nHCl = 3,36/22,4 = 0,15
--> nHCl = 0,15 x 2 = 0,3 mol nặng 0,3 x 36,5 = 10,95 gam.
--> dung dịch axit HCl 7,3% nặng 10,95/0,073 = 150 gam.
Mà
m dung dịch sau phản ứng = m dung dịch axit + m C - m CO2 bay ra
= 150 + 14,2 - (0,15 x 44) = 157,6 gam
--> m MgCl2 = 0,06028 x 157,6 = 9,5 gam
--> n MgCl2 = 9,5/95 = 0,1 mol = n MgCO3
--> m MgCO3 = 0,1 x 84 = 8,4 gam chiếm 8,4/14,2 = 59,154929%
--> m R(2/a)CO3 = 14,2 - 8,4 = 5,8 gam chiếm 5,8/14,2 = 40,845071%
--> n R(2/a)CO3 = 0,15 - 0,1 = 0,05 mol.
--> PTK của R(2/a)CO3 = 5,8/0,05 = 116.
--> 2M/a = 116 - 60 = 56 hay M = 23a.
Chọn a = 2 với M = 56 --> R là Fe.
b) Khối lượng chất rắn sau khi nung đến khối lượng không đổi là khối lượng của 0,1 mol MgO và 0,05 mol FeO(1,5). (FeO(1,5) là cách viết khác của Fe2O3. Cũng là oxit sắt 3 nhưng PTK chỉ bằng 80).
m chất rắn sau khi nung = (0,1 x 40) + (0,05 x 80) = 8 gam.





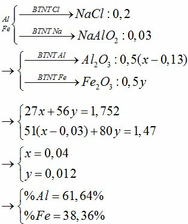
gọi x la so mol cua Fe
y la so mol cua FeO
\(n_{H_2SO_4}=0,3.1=0,3\left(mol\right)\)
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
de: x \(\rightarrow\) x \(\rightarrow\) x \(\rightarrow\) x
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2
de: y \(\rightarrow\) y \(\rightarrow\) y \(\rightarrow\) y
Ta co: 56x + 72y = 18,4
x + y = 0,3
\(\Rightarrow\) x = 0,2 y = 0,1
a, \(m_{Fe}=56.0,2=11,2g\)
\(m_{FeO}=72.0,1=7,2g\)
\(\%m_{Fe}=\dfrac{11,2}{18,4}.100\%\approx60,87\%\)
\(\%m_{FeO}=100-60,87\approx39,13\%\)
b, \(m_{FeSO_4}=152.\left(0,1+0,2\right)=45,6g\)
\(m_{dd}=18,4+300.1,65-0,4=513g\)
\(C\%=\dfrac{45,6}{513}.100\%\approx8,89\%\)