Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt công thức muối cacbonat là M2CO3 có số mol x , muối hiđrocacbonat là MHCO3 có số mol y mol
M2CO3+ 2HCl → 2MCl + CO2+ H2O
x x mol
MHCO3+ HCl→ MCl + CO2+ H2O
y y mol
Ta có: \(n_{CO_2}=x+y=0,25\left(mol\right)=n_{hh2muối}\)
=> \(\overline{M_{hh}}=\dfrac{30}{0,25}=120\left(g/mol\right)\)
Ta có: M+61< 120< 2M + 60
=> 30<M<59
=> Chỉ có Kali thỏa mãn

\(n_{H_2}=\dfrac{4,368}{22,4}=0,195\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: x x
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Mol: y 1,5y
Ta có: \(\left\{{}\begin{matrix}24x+27y=3,87\\x+1,5y=0,195\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,06\\y=0,09\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,06.24.100\%}{3,87}=37,21\%\)
\(\%m_{Al}=100-37,21=62,79\%\)

a) Sửa đề: dd H2SO4 9,8%
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=0,35\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,35\cdot98}{9,8\%}=350\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{H_2SO_4}-m_{H_2}=361,6\left(g\right)\)
b) Tương tự câu a

2al+6hcl-> 2alcl3+ 3h2
fe+2hcl-> fecl2+h2
nh2=13,44/22,4=0,6 mol
27a+56b=16,5
1,5a+ b=0,6
a=0,3, b=0,15
%mal=0,3*27/16,5*100=49,09%
%mfe=50,9%
nhcl=3a+2b=1,2
Vdd hcl=1,2/2=0,6l

\(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\\n_{Fe}=c\left(mol\right)\end{matrix}\right.\)⇒ 24a + 27b + 56c = 26,05(1)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al +6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\)
\(Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = a + 1,5b + 1,5c = \dfrac{17,36}{22,4} = 0,775(3)\)
Từ (1)(2)(3) suy ra: a = 0,325 ; b = -0,05 ; c = 0,35
→ Sai đề.

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
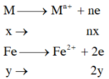
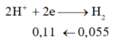
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
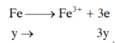
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C
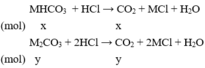
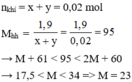


13:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(2Fe+3Cl_2\rightarrow FeCl_3\)
\(Mg+Cl_2\rightarrow MgCl_2\)
\(n_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{Cl2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Gọi a là số mol Fe b là số mol Mg
\(\left\{{}\begin{matrix}1,5a+b=0,25\\a+b=0,2\end{matrix}\right.\Rightarrow a=b=0,1\left(mol\right)\)
\(\%m_{Mg}=\frac{0,1.24}{0,1.56+0,1.24}.100\%=30\%\)
14:
Công thức 2 muối: MHCO3; M2CO3
nCO2= 0,02 mol
Ta có:
\(M+61< \frac{1,9}{0,02}< 2M+60\)
\(\Rightarrow17,5< M< 35\)
Vậy M là: Na