Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cl_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2M + Cl2 --to--> 2MCl
________0,075---->0,15
=> \(M_{MCl}=\dfrac{11,175}{0,15}=74,5\left(g/mol\right)\)
=> MM = 39 (K)

a)
\(n_{Cl_2} = \dfrac{6,72}{22,4}\ =0,3(mol)\)
mmuối= mkim loại + mCl2 = 8,3 + 0,3.71 = 29,6(gam)
b)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\)⇒27x + 56y = 8,3(1)
\(2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\)
Suy ra : 1,5x + 1,5y = 0,3(2)
Từ (1)(2) suy ra : x = 0,1 ; y = 0,1
Vậy :
\(\%m_{Al} = \dfrac{0,1.27}{8,3}.100\% = 32,53\%\\ \%m_{Fe} = 100\% - 32,53\% = 67,47\%\)
\(Đặt:n_{Al}=x\left(mol\right),n_{Fe}=y\left(mol\right)\)
\(m_{hh}=27x+56y=8.3\left(g\right)\left(1\right)\)
\(n_{Cl_2}=0.3\left(mol\right)\)
\(2Al+3Cl_2\underrightarrow{t^0}2AlCl_3\)
\(2Fe+3Cl_2\underrightarrow{t^0}2FeCl_3\)
\(n_{Cl_2}=1.5x+1.5y=0.3\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.1\)
\(m_{Muối}=m_{AlCl_3}+m_{FeCl_3}=0.1\cdot133.5+0.1\cdot162.5=29.6\left(g\right)\)
\(\%Al=\dfrac{2.7}{8.3}\cdot100\%=32.53\%\)
\(\%Fe=100-32.53=67.47\%\)

\(n_M=\dfrac{1,6}{M_M}\left(mol\right)\)
PTHH: M + Cl2 --to--> MCl2
____\(\dfrac{1,6}{M_M}\)----------->\(\dfrac{1,6}{M_M}\)
=> \(\dfrac{1,6}{M_M}\left(M_M+71\right)=4,44=>M_M=40\left(Ca\right)\)
\(n_{Ca}=\dfrac{1,6}{40}=0,04\left(mol\right)\)
PTHH: Ca + Cl2 --to--> CaCl2
_____0,04->0,04
=> VCl2 = 0,04.22,4 = 0,896(l)

Đặt nZn = x mol; nFe = y mol.
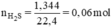
Ta có hệ phương trình: 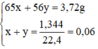
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

m giảm = mO2 = 0.8 (g)
BT e :
5nKMnO4 = 4nO2 + 2nCl2
=> nCl2 = (5*31.6/158 - 4*0.8/32)/2 = 0.45 (mol)
2NaOH + Cl2 => NaCl + NaClO + H2O
0.9______0.45
Vdd NaOH = 0.9/0.1 = 9 (l)
Em xem lại đáp án của đề nhé !!!

Khối lượng dung dịch tăng = m hỗn hợp kim loại - m khí H2 thoát ra
\(\Rightarrow\Delta m=m_{hh\left(kl\right)}-m_{H2}\)
\(\Rightarrow10,2=m_{hh\left(kl\right)}-m_{H2}\rightarrow m_{hh\left(kl\right)}=10,2+m_{H2}\)
Bảo toàn mol H \(\Rightarrow n_{HCl}=2n_{H2}\)
Áp dụng BTKL:
\(m_{hh\left(kl\right)}+36,5.n_{HCl}=39,4+2.n_{H2}\)
\(\Rightarrow10,2+m_{H2}+36,5.2.n_{H2}=39,4+2.n_{H2}\)
\(\Rightarrow10,2+2.n_{H2}+36,5.2.n_{H2}=39,4+2.n_{H2}\)
\(\Rightarrow n_{H2}=0,4\left(mol\right)\)
\(\Rightarrow m_{H2}=0,4.2=0,8\left(mol\right)\)
\(m_{hh\left(kl\right)}=10,2+0,8=11\left(g\right)\)
Gọi số mol Al, Fe lần lượt là x;y
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có HPT:
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\%m_{Al}=\frac{5,4}{11}.100\%=49,1\%\)
\(\Rightarrow\%m_{Fe}=100\%-49,1\%=50,9\%\)

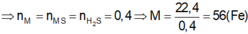
Đặt kim loại A có hóa trị x (x:nguyên, dương)
\(2A+xCl_2\underrightarrow{^{to}}2ACl_x\\ m_{Cl_2}=32,5-11,2=21,3\left(g\right)\\ n_{Cl_2}=\dfrac{21,3}{71}=0,3\left(mol\right)\\ n_A=\dfrac{0,3.2}{x}=\dfrac{0,6}{x}\left(mol\right)\\ \Rightarrow M_A=\dfrac{11,2}{\dfrac{0,6}{x}}=\dfrac{56}{3}x\\ \Rightarrow Nhận:x=3\Rightarrow M_A=56\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Sắt\left(Fe=56\right)\)