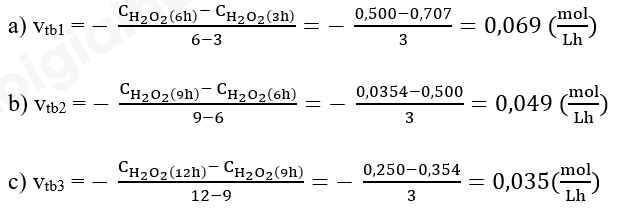Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

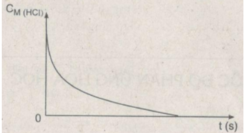
a) Theo thời gian, nồng độ có xu hướng tăng dần
=> Đồ thị mô tả sự thay đổi nồng độ theo thời gian của sản phẩm HCl
b) Đơn vị của tốc độ phản ứng trong trường hợp này là phút (min).

Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.

- Nồng độ chất phản ứng giảm dần theo thời gian
- Nồng độ chất sản phẩm tăng dần theo thời gian

a) Đồ thị em vẽ mãi không được a tham khảo tí nhé :v
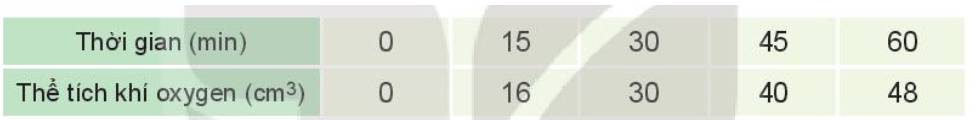
Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian: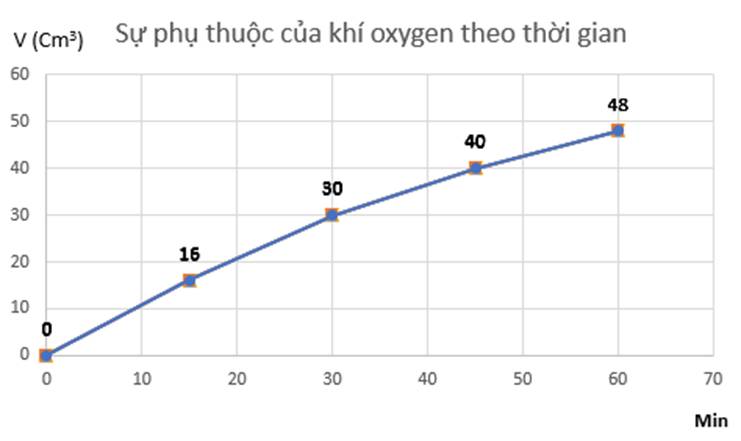 b)
b)
Ta có công thức tính vận tốc trung bình: \(V_{tb}=\dfrac{S_1+S_2....}{t_1+t_2....}\)
Tốc độ trung bình của phản ứng từ 0 - 15 phút là:
\(V_{tb_1}=\dfrac{16-0}{15-0}=1,0666....\approx1,067\) (cm3/min)
Tốc độ trung bình của phản ứng từ 15 - 30 phút là:
\(V_{tb_2}=\dfrac{30-16}{30-15}=0,9333....\approx0,933\) (cm3/min)
Tốc độ trung bình của phản ứng từ 30 - 45 phút là:
\(V_{tb_3}=\dfrac{40-30}{45-30}=0,66666.....\approx0,667\) (cm3/min)
Tốc độ trung bình của phản ứng từ 45 - 60 phút là:
\(V_{tb_4}=\dfrac{48-40}{60-45}=0,5333.....\approx0,533\) (cm3/min)
Ta thấy \(V_{tb_1}>V_{tb_2}>V_{tb_3}>V_{tb_4}\)
=> Tốc độ trung bình của phản ứng giảm dần theo thời gian.

Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCL theo thời gian

a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1

a) Biểu thức tốc độ tức thời của phản ứng là:
v1 = k.CCl2.CH2
b) Gọi CCl2 là nồng độ ban đầu của Cl, CH2 là nồng độ đầu của H2
=> v2 = k. CCl2.CH2 :2
=> 2v2 = v1
=> Tốc độ phản ứng giảm 1 nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2

- Phản ứng có kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng đóng vai trò quan trọng trong đời sống:
+ Cung cấp nhiệt cho các nhu cầu đun nấu thức ăn
+ Giảm nhiệt độ của môi trường xung quanh

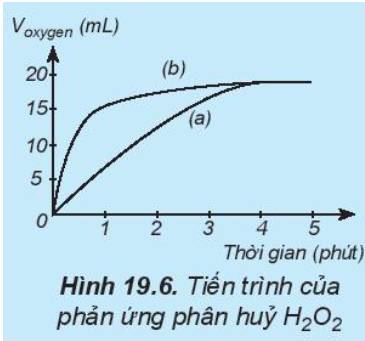
Trong cùng khoảng thời gian, thể tích khí oxygen được biểu diễn theo đường (b) lớn hơn so với đường (a).
=> Đường phản ứng (a) tương ứng với phản ứng không có xúc tác.
Đường phản ứng (b) tương ứng với phản ứng có xúc tác.
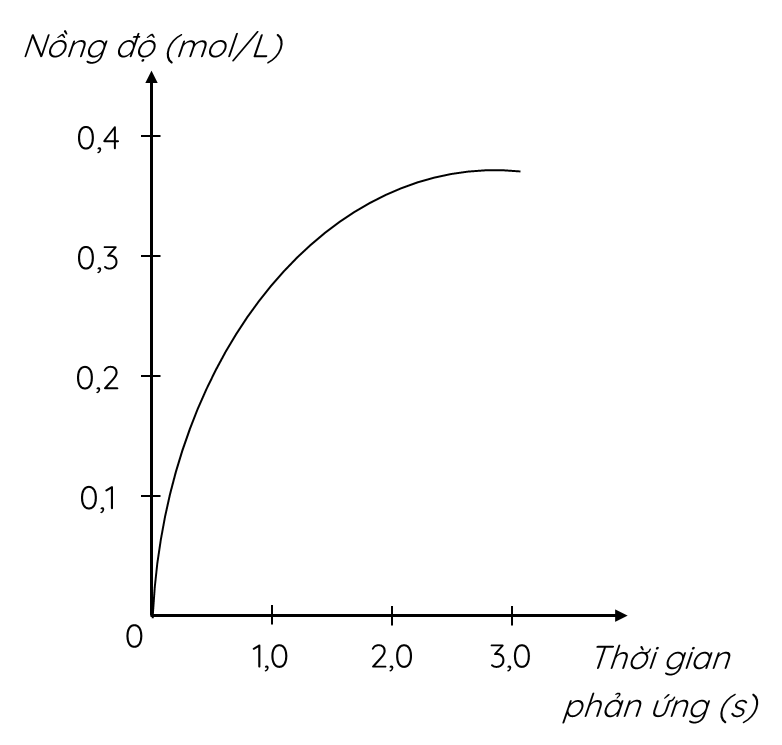
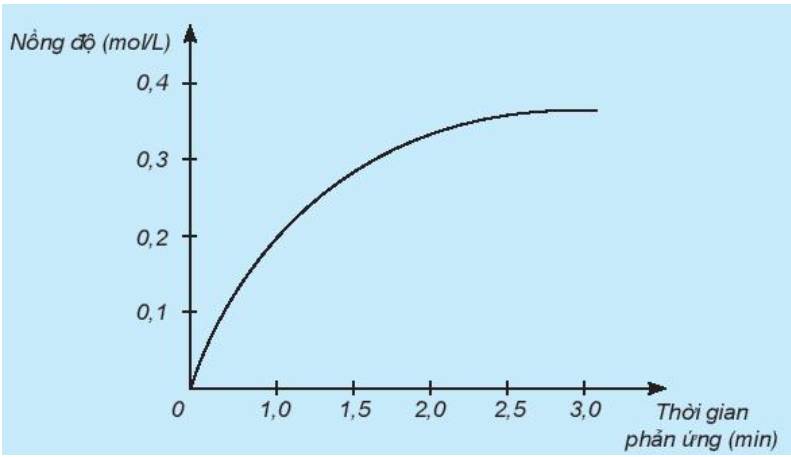 a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?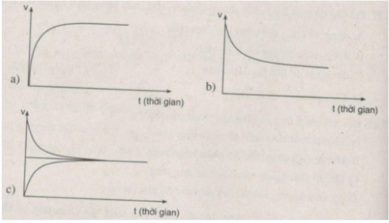
 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là: