Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đề cho có bị sai số liệu không?
Thể tích khí Cl2 sao lại là 13,32(l) ????
Cho 6,9g kim loại kiềm X vào nước thu được 3,36lít khí H2 (đkc). Xác định kim loại kiềm X đã sử dụng

$2X + 2H_2O \to 2XOH + H_2$
$n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$n_X = 2n_{H_2} = 0,3(mol)$
$\Rightarrow M_X = \dfrac{6,9}{0,3} = 23(Natri)$
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ 2X+2nH_2O\rightarrow2X\left(OH\right)_n+H_2\uparrow\\ \Rightarrow n_x=2.0,15=0,3\left(mol\right)\\ M_x=\dfrac{6,9}{0,3}=23\\ \)
⇒X là Na

\(n_{SO_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
PTHH: \(2Al+6H_2SO_4\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O\\ Mg+2H_2SO_4\underrightarrow{t^o}MgSO_4+SO_2+2H_2O\)
Đặt \(n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\)
Ta có \(\left\{{}\begin{matrix}27a+24b=7,65\\1,5a+b=0,375\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{27.0,15}{7,65}.100\%=52,94\%\\ \%m_{Mg}=100\%-52,94\%=47,06\%\)

Đáp án B
- Khi cho hỗn hợp tác dụng với H2SO4 loãng dư chỉ có Mg phản ứng sinh ra khí H2 => nMg=nH2=0,15 mol
- Khi cho hỗn hợp tác dụng với HNO3 dư => Chỉ có Cu và Mg (kim loại thay đổi số oxi hóa)
BT e: nCu=(3nNO-2nMg)/2=0,15 mol
=>mCu=0,15.64=9,6 gam
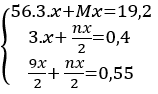


Câu 1 :
- Nhôm tan dần, sủi bọt khí không màu
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
Câu 2 :
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(X+H_2O\rightarrow XOH+\dfrac{1}{2}H_2\)
\(0.3...............................0.15\)
\(M_X=\dfrac{6.9}{0.3}=23\)
\(X:Na\)