Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức hóa học của oxit sắt là: F e x O y :
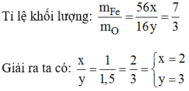
Công thức hóa học: F e 2 O 3 .

CTPT: FexOy
Có: \(\dfrac{m_{Fe}}{m_O}=\dfrac{56x}{16y}=\dfrac{7}{3}\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTPT: Fe2O3
Gọi CTHH là \(Fe_xO_y\)
\(x:y=\dfrac{m_{Fe}}{56}:\dfrac{m_O}{16}=\dfrac{7}{56}:\dfrac{3}{16}=\dfrac{1}{8}:\dfrac{3}{16}=1:\dfrac{3}{2}=2:3\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Fe_2O_3\)

1. Gọi CTHH của oxit là NxOy.
Ta có: \(\dfrac{m_N}{m_O}=\dfrac{7}{20}\Rightarrow\dfrac{n_N}{n_O}=\dfrac{7}{20}:\dfrac{14}{16}=\dfrac{2}{5}\)
⇒ x:y = 2:5
→ N2O5
2. Gọi CTHH cần tìm là FexOy.
\(\Rightarrow\dfrac{m_{Fe}}{m_O}=\dfrac{7}{2}\Rightarrow\dfrac{n_{Fe}}{n_O}=\dfrac{7}{2}:\dfrac{56}{16}=1\)
⇒ x:y = 1
→ FeO
3. CTHH cần tìm: RO2
Mà: %R = 46,7%
\(\Rightarrow\dfrac{M_R}{M_R+16.2}.100\%=46,7\%\)
⇒ MR = 28 (g/mol)
→ SiO2

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
\(CTĐG:SO_3\)
\(CTCtrởthành:\left(SO_3\right)n=80\)
\(\Leftrightarrow n=1\)
Vậy CTHH: SO3

a)\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(C_4H_{10}+\dfrac{13}{2}O_2\underrightarrow{t^o}4CO_2+5H_2O\)
b)Gọi CTHH là \(Fe_xO_y\)
\(x:y=\dfrac{m_{Fe}}{56}:\dfrac{m_O}{16}=\dfrac{7}{56}:\dfrac{3}{16}=0,125:0,1875=2:3\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Fe_2O_3\)

Khối lượng của các nguyên tố trong hợp chất là:
\(m_{FE}=\dfrac{70.160}{100}=112\left(g\right)\)
\(m_O=\dfrac{30.160}{100}=48\left(g\right)\)
Số mol có trong mỗi nguyên tố là:
\(n_{FE}=\dfrac{m_{FE}}{M_{FE}}=\dfrac{112}{56}=2\left(mol\right)\)
\(n_O=\dfrac{m_O}{M_O}=\dfrac{48}{16}=3\left(mol\right)\)
Vậy hợp chất có 2 nguyên tử Fe, 3 nguyên tử O
Công thức hóa học của hợp chất là: \(FE_2O_3\)

CTPT: AlxOy
Có: \(\dfrac{m_{Al}}{m_O}=\dfrac{27x}{16y}=\dfrac{4,5}{4}\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTPT: Al2O3
Gọi CTHH là \(Al_xO_y\)
\(x:y=\dfrac{m_{Al}}{27}:\dfrac{m_O}{16}=\dfrac{4,5}{27}:\dfrac{4}{16}=\dfrac{1}{6}:\dfrac{1}{4}=1:\dfrac{3}{2}=2:3\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Al_2O_3\)
2.
Oxit có dạng FexOy
\(\rightarrow56x+16y=72\)
Ta có \(\%m_{Fe}=\frac{56x}{72}=77,78\%\rightarrow x=1\rightarrow y=1\)
Vậy Oxit là FeO
3.
Sửa đề :5,25:2
Oxit có dạng FexOy
\(\rightarrow m_{Fe}:m_O=56x:16y=5,25:2\)
\(\Rightarrow56x=16y.\frac{5,25}{2}\Rightarrow56x=42y\)
\(\Rightarrow x:y=42:56=3:4\)
\(\Rightarrow\) Fe3O4
bài1