Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl

1:
Sửa đề: Số hạt mang điện ít hơn 10
Theo đề, ta có:
\(\left\{{}\begin{matrix}2Z+N=122\\2Z-N=-10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}4Z=112\\2Z-N=-10\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}Z=28\\N=2Z+10=66\end{matrix}\right.\)
Số khối là:
28+66=94

Ta có: P + E + N = 40
Mà P = E
=> 2P + N =40 (1)
Có tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt
=> 2P \(-\) N = 12 (2)
Từ (1) và (2) ta có hệ phương trình
\(\left\{{}\begin{matrix}2P+N=40\\2P-N=12\end{matrix}\right.\)
=> P = 13
N = 14
Số khối của X là: A = P + N = 13 +14 = 27

ta co p+e+n=93 mà p=e=z => 2z+n=93
2z-n=23 ( vì số hạt mang điện nhiều hơn số hạt ko mang điện là 23)
tu 2 pt trên ta có z =29,,n=35
=> số hiệu nguyên tử của B = Z = 29
cấu hình electron
\(1s^22s^22p^63s^23p^64s^23d^9\)
đối với các dạng bài này , bạn cần nhớ kiến thức như sau :
Tổng số hạt trong nguyên tử = 2p + n ( gồm có 3 loại hạt : n , p, e trong đó p=e)
số hạt mang điện là 2p
số hạt không mang điện là n
số hiệu nguyên tử là Z= p = e = số thứ tự nhóm .
Sau khi xác định được p ,, tức là cũng xác định được e thì
cấu hình viết theo dãy trật tự các mức năng lượng
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.......
Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim. Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim

gọi số proton, electron, notron lần lượt là p,e,n
Bài 1 : ta có hệ : 2p+n=36
2p-n=12
<=>p=e=12; n=12
=> Z=12=> A=12+12=24
Bài 2 theo đề ta có hệ sau:
2p+n=36
2p-2n=0
<=> p=e=n=12
=> Z=12=> A=12+12=24
Bài 3: theo đề ta có hệ :
2p+n=36
p-n=0
<=> p=n=e=12
=> Z=6=>A=12+12=24

Ta có: P + N + E = 48
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 48 (1)
Có: Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=14,5\\N=19\end{matrix}\right.\) → vô lý
Bạn xem lại đề nhé.

a, Ta có: P + N + E = 34
Mà: P = E (Do nguyên tử trung hòa về điện.)
⇒ 2P + N = 34 (1)
Theo đề, số hạt mang điện nhiều hơn số hạt không mang điện là 10.
⇒ 2P - N = 10 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}P=E=11=Z\\N=12\end{matrix}\right.\) ⇒ A = 11 + 12 = 23
→ KH: \(^{23}_{11}X\)
b, Cấu hình e: 1s22s22p63s1
Cấu hình e theo orbital:
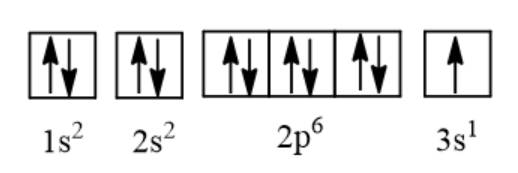
c, X có 1 e hóa trị → tính kim loại
d, - Z = 11 → ô số 11
- Có 3 lớp e → chu kỳ 3
- e cuối cùng phân bố ở phân lớp s, có 1 e hóa trị → nhóm IA
Vậy: X thuộc ô số 11, chu kỳ 3, nhóm IA
Câu 1:
Số hiệu nguyên tử=P=E=29
Số khối A=P+N suy ra N=A-P=61-29=32. Câu b đúng
Câu 2:
2P+N=40
2P-N=2
Giải ra P=10,5(sai đề)
- Sửa lại đề: Trong hạt nhân số hạt mang điện nhiều hơn không mang điện là 2
2P+N=40
P-N=2
Giải ra P+14, N=12
A=P+N=26 đáp án b
Câu 3:
2P+N=36
P=N
Giải ra P=N=12
- Ý 1 đáp án C 12
- Ý 2 đáp án b 24
Câu 4:
2P+N=36
2P=2N
giải ra P=N=12
Đáp án b 12