Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

m Fe sau phản ứng=28-0,1x56+0,1x64=28,8 g bạn vào giải thích giúp mình vs
tham khảo thử:
Hòa tan 20,8 (g) hỗn hợp X gồm Cu và CuO bằng một lượng vừa đủ 200 (ml) dung dịch axit HCL 1M 1) Viết phương trình phản ứng xảy ra ? Dung dịch sau phản ứng có màu gì ?
2) Tính thành phần phần trăm theo khôi lượng của Cu có trong hỗn hợp X.
3) Cho thanh Fe mỏng nặng 28(g) vào dung dịch sau phản ứng trên . Tính khối lượng thanh Fe khi phản ứng kết thúc ( coi tất cả kim loại đêu bám vào thanh Fe)
Giải thích các bước giải:
1) CuO+2HCl->CuCl2+H2O
dd có màu xanh làm
2) nHCl=0,2x1=0,2 mol
=>nCuO=0,1 mol
mCu=20,8-0,1x80=12,8 g
%mCu=12,8/20,8x100%=61,54%
3) Fe+CuCl2->FeCl2+Cu
0,1 0,1 0,1
m Fe sau phản ứng=28-0,1x56+0,1x64=28,8 g

HD:
Fe + CuSO4 ---> FeSO4 + Cu
x x mol x x
a) Khối lượng Fe tăng lên = mCu (thoát ra) - mFe (tan vào dd) ---> 4%.50 = 64.x - 56x ---> x = 0,25 mol.
---> mCu = 64x = 64.0,25 = 16 gam.
b) [FeSO4] = 0,25/0,4 = 0,625 M; [CuSO4] = (0,4 - 0,25)/0,4 = 0,375 M.

thôi thì mình làm cho bn vậy, câu a ko làm dc đâu, làm câu b thôi, làm sao biết dc chất nào dư khi chỉ có số mol 1 chất?
nK2SO3=0.1367(mol)
mddH2SO4=Vdd.D=200.1,04=208(g)
K2SO3+H2SO4-->K2SO4+H2O+SO2
0.1367----0.1367----0.1367---------0.1367 (mol)
mddspu=100+208-0,1367.64=299.2512(g) ; mK2SO4=0,1367.174=23.7858(g)
==>C%=23.7858.100/299.512=7.94%
2)pt bn tự ghi nhé
ta có hệ pt: 56a+27b=11 và a+3b/2=8.96/22.4==>a=0.1, b=0.2
==>%Fe=0.1x56x100/11=50.9%
%Al=100%-50.9%=49.1%
b)nH2SO4= 0.7(mol)==>VddH2SO4=0.7/2=0.35(L)

\(a)2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ b)n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\\ n_{Al}=a;n_{Fe}=b\\ \left\{{}\begin{matrix}3a+b=0,25\\27a+56b=8,3\end{matrix}\right.\\ a=\dfrac{19}{470};b=\dfrac{121}{940}\\ \%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{8,3}\cdot100=13,15\%\\ \%m_{Fe}=100-13,15=86,85\%\\ c)n_{HCl}=3\cdot\dfrac{19}{470}+2\cdot\dfrac{121}{940}=\dfrac{89}{235}mol\\ m_{ddHCl=}=\dfrac{\dfrac{89}{235}\cdot36,5}{7,3}\cdot100=189g\\ d)n_{AlCl_3}=n_{Al}=\dfrac{19}{470}mol\\ n_{Fe}=n_{FeCl_2}=\dfrac{121}{940}mol\)
\(m_{dd}=8,3+189-0,25.2=196,8g\\ C_{\%AlCl_3}=\dfrac{\dfrac{19}{470}\cdot133,8}{196,8}\cdot100=2,8\%\\ C_{\%FeCl_2}=\dfrac{\dfrac{121}{940}127}{196,8}\cdot100=8,3\%\)
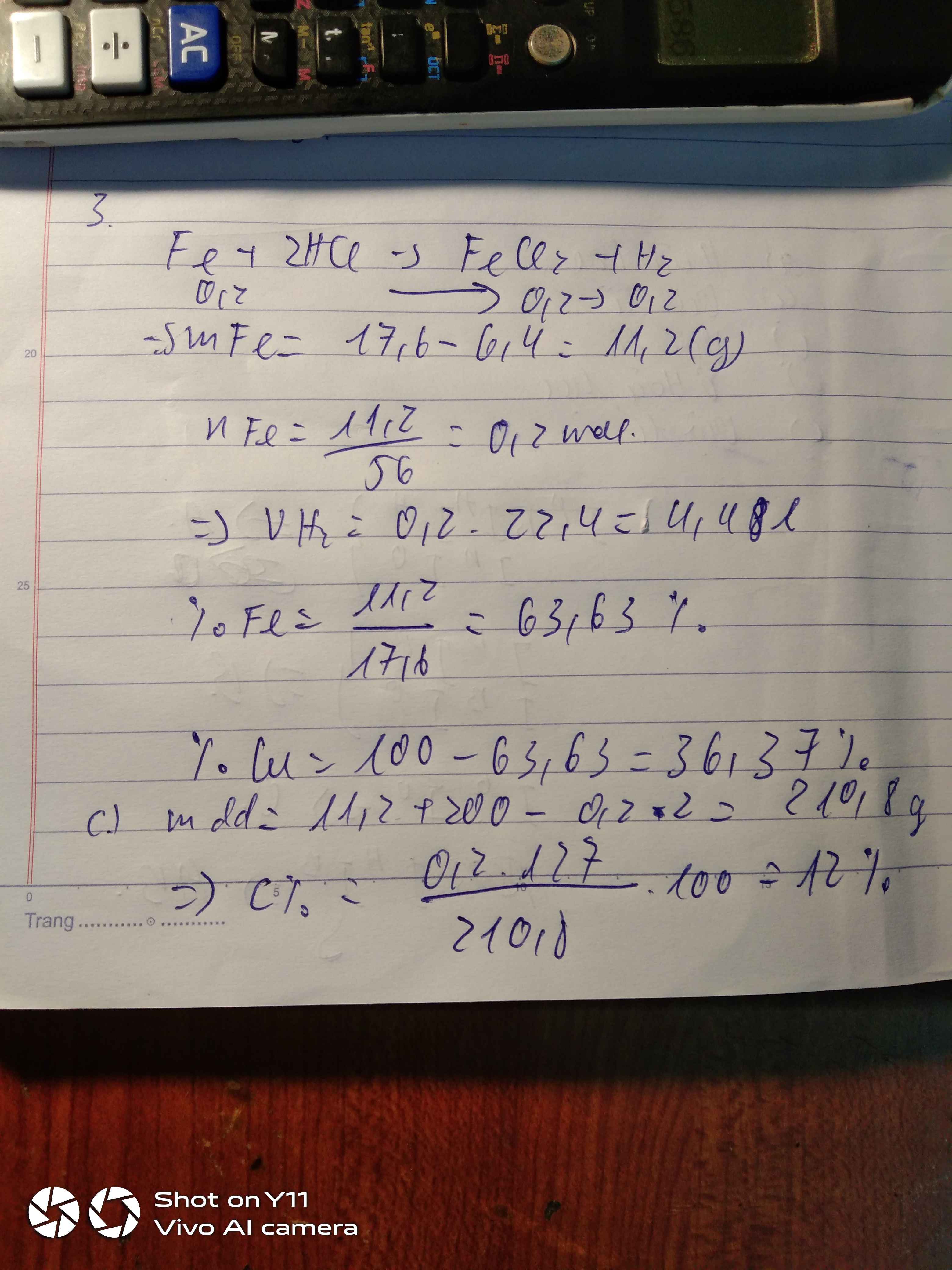


a) CuO+2HCl--->CuCl2+H2O
Sau phản ứng có xuất hiện chất rắn màu đỏ và dd màu xanh lơ
b) Ta có
n HCl=0,2.1=0,2(mol)
Theo pthh
n CuO=1/2n HCl=0,1(mol)
m CuO=0,1.80=8(g)
m Cu=20,8-8=12,8(g)
%m Cu=\(\frac{8}{20,8}.100\%=38,5\%\)
c) Fe+CuCl2--->FeCl2+Cu
n Fe=28/56=0,5(mol)
Theo n CuCl2=0,1(mol)
--->Fe dư
Theo pthh
n Fe=n CuCl2=0,1(mol)
n Fe dư=0,5-0,1=0,4(mol)
m Fe=0,4.56=22,4(g)
a. CuO+2HCl\(\rightarrow\)CuCl2+H2O
Cu không phản ứng HCl
Dung dịch sau phản ứng có màu xanh là màu của ion Cu2+
b. nHCl=0,2\(\rightarrow\)nCuO=0,1
\(\rightarrow\)mCuO=0,1.80=8g\(\rightarrow\)mCu=20,8-8=12,8g
\(\rightarrow\)%mCu=\(\frac{12,8}{20,8}\)=61,54%
c. nFe=0,5mol
Fe+CuCl2\(\rightarrow\)FeCl2+Cu
0,5____0,1
\(\rightarrow\)nFe phản ứng=nCuCl2 phản ứng=nCu tạo thành=0,1
\(\rightarrow\)Khối lượng thanh Fe sau phản ứng:
m=28-0,1.56+0,1.64=28,8g