Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{24}{32}=0,75\left(mol\right)\)
\(PTHH:4P+5O_2\rightarrow2P_2O_5\)
Ban đầu : 0,4 0,75 (mol)
Phản ứng : 0,4 0,5 0,2 (mol)
Sau phản ứng : 0 0,25 0,2 (mol)
Chất \(O_2\) dư. \(m_{O_2}=0,25.32=8\left(g\right)\)
Chất \(P_2O_5\) tạo thành. \(m_{P_2O_5}=0,2.142=2,8\left(g\right)\)
Bài 1 trên
Bài 2: \(n_S=\dfrac{24}{32}=0,75\left(mol\right)\)
\(n_{O_2}=\dfrac{26}{32}=0,8125\left(mol\right)\)
\(PTHH:S+O_2\rightarrow SO_2\)
Ban đầu : 0,75 0,8125 (mol)
Phản ứng : 0,75 0,75 0,75 (mol)
Sau phản ứng : 0 0,0625 0,75 (mol)
Chất O2 dư. \(m_{O_2}=0,0625.32=2\left(g\right)\)
Chất SO2 tạo thành. \(m_{SO_2}=0,75.64=48\left(g\right)\)

a)
Số mol photpho : 0,4 (mol).
Số mol oxi : 0,53 (mol).
Phương trình phản ứng :
4P + 5O2 -> 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
b) Chất được tạo thành là P2O5 . Theo phương trình phản ứng, ta có :
0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là : m = 0,2.(31.2 + 16.5) = 28,4 gam.
a) PTHH: 4P + 5O2 -to-> 2P2O5
Ta có: \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{0,4}{4}< \dfrac{\dfrac{17}{32}}{5}\)
=> P hết, O2 dư nên tính theo nP.
=> \(n_{O_2\left(phảnứng\right)}=\dfrac{5.0,4}{4}=0,5\left(mol\right)\\ =>n_{O_2\left(dư\right)}=\dfrac{17}{32}-0,5=\dfrac{1}{32}\left(mol\right)\)
b) Chất tạo thành sau phản ứng là P2O5 (điphotpho pentaoxit).
Theo PTHH và đề bài, ta có:
\(n_{P_2O_5}=\dfrac{2.0,4}{4}=0,2\left(mol\right)\)
Khối lượng P2O5 tạo thành sau phản ứng:
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

\(1,2H_2+O_2\underrightarrow{t}2H_2O\)
\(2Mg+O_2\underrightarrow{t}2MgO\)
\(2Cu+O_2\underrightarrow{t}2CuO\)
\(S+O_2\underrightarrow{t}SO_2\)
\(4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(C+O_2\underrightarrow{t}CO_2\)
\(4P+5O_2\underrightarrow{t}2P_2O_5\)
\(2,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(a,n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(b,n_C=0,3\left(mol\right)\Rightarrow n_{CO_2}=0,3\left(mol\right)\Rightarrow m_{CO_2}=13,2\left(g\right)\)
c, Vì\(\frac{0,3}{1}>\frac{0,2}{1}\)nên C phản ửng dư, O2 phản ứng hết, Bài toán tính theo O2
\(n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(3,PTHH:CH_4+2O_2\underrightarrow{t}CO_2+2H_2O\)
\(C_2H_2+\frac{5}{2}O_2\underrightarrow{t}2CO_2+H_2O\)
\(C_2H_6O+3O_2\underrightarrow{t}2CO_2+3H_2O\)
\(4,a,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_P=1,5\left(mol\right)\Rightarrow n_{O_2}=1,2\left(mol\right)\Rightarrow m_{O_2}=38,4\left(g\right)\)
\(b,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_C=2,5\left(mol\right)\Rightarrow n_{O_2}=2,5\left(mol\right)\Rightarrow m_{O_2}=80\left(g\right)\)
\(c,PTHH:4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(n_{Al}=2,5\left(mol\right)\Rightarrow n_{O_2}=1,875\left(mol\right)\Rightarrow m_{O_2}=60\left(g\right)\)
\(d,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(TH_1:\left(đktc\right)n_{H_2}=1,5\left(mol\right)\Rightarrow n_{O_2}=0,75\left(mol\right)\Rightarrow m_{O_2}=24\left(g\right)\)
\(TH_2:\left(đkt\right)n_{H_2}=1,4\left(mol\right)\Rightarrow n_{O_2}=0,7\left(mol\right)\Rightarrow m_{O_2}=22,4\left(g\right)\)
\(5,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=0,46875\left(mol\right)\)
\(n_{SO_2}=0,3\left(mol\right)\)
Vì\(0,46875>0,3\left(n_{O_2}>n_{SO_2}\right)\)nên S phản ứng hết, bài toán tính theo S.
\(a,\Rightarrow n_S=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_S=9,6\left(g\right)\)
\(n_{O_2}\left(dư\right)=0,16875\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=5,4\left(g\right)\)
\(6,a,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_C=1,5\left(mol\right)\Rightarrow m_C=18\left(g\right)\)
\(b,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_{H_2}=0,75\left(mol\right)\Rightarrow m_{H_2}=1,5\left(g\right)\)
\(c,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_S=1,5\left(mol\right)\Rightarrow m_S=48\left(g\right)\)
\(d,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_P=1,2\left(mol\right)\Rightarrow m_P=37,2\left(g\right)\)
\(7,n_{O_2}=5\left(mol\right)\Rightarrow V_{O_2}=112\left(l\right)\left(đktc\right)\);\(V_{O_2}=120\left(l\right)\left(đkt\right)\)
\(8,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(m_C=0,96\left(kg\right)\Rightarrow n_C=0,08\left(kmol\right)=80\left(mol\right)\Rightarrow n_{O_2}=80\left(mol\right)\Rightarrow V_{O_2}=1792\left(l\right)\)
\(9,n_p=0,2\left(mol\right);n_{O_2}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
Vì\(\frac{0,2}{4}< \frac{0,3}{5}\)nên P hết O2 dư, bài toán tính theo P.
\(a,n_{O_2}\left(dư\right)=0,05\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=1,6\left(g\right)\)
\(b,n_{P_2O_5}=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=14,2\left(g\right)\)

Bài 2: (chị Hương Giang làm cho bạn bài 1 rồi)
Áp dụng ĐLBTKL, ta có:
mM + mO2 = mM2On
=> mO2 = 4 - 2,4 = 1,6 (g)
nO2 = 1,6/32 = 0,05 (mol)
PTHH: 4M + nO2 -> (to) 2M2On
Mol: 0,2/n <--- 0,05
M(M) = 2,4/(0,2/n) = 12n (g/mol)
Xét:
n = 1 => Loại
n = 2 => M = 24 => Mg
n = 3 => Loại
Vạya M là Mg

a. \(n_{Mg}=\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: \(2Mg+O_2\rightarrow^{t^0}2MgO\)
-Theo PTHH: 2 1 2 (mol)
-Theo đề bài: 0,2 0,1 (mol)
-So sánh tỉ lệ số mol đề bài với số mol phương trình của Mg và O2 có:
\(\dfrac{0,2}{2}=\dfrac{0,1}{1}\)
\(\Rightarrow\) Mg và O2 phản ứng hết.
b. -Chất tạo thành: Magie oxit.
\(n_{MgO}=\dfrac{0,1.2}{1}=0,2\) (mol)
\(\Rightarrow m_{MgO}=n.M=0,2.40=8\left(g\right)\)

a) \(n_{Al}=\dfrac{12,15}{27}=0,45\left(mol\right)\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
Xét tỉ lệ: \(\dfrac{0,45}{4}>\dfrac{0,3}{3}\)=> Al dư, O2 hết
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,4<--0,3-------->0,2
=> \(m_{Al\left(dư\right)}=\left(0,45-0,4\right).27=1,35\left(g\right)\)
b) \(m_{Al_2O_3}=0,2.102=20,4\left(g\right)\)

\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(n_{O_2}=\dfrac{16}{32}=0,5mol\)
\(S+O_2\underrightarrow{t^o}SO_2\)
0,2 0,5 0,2
Sau phản ứng oxi còn dư và dư \(0,5-0,2=0,3mol\)
Oxit axit được tạo thành là \(SO_2\) và có khối lượng:
\(m_{SO_2}=0,2\cdot64=12,8g\)

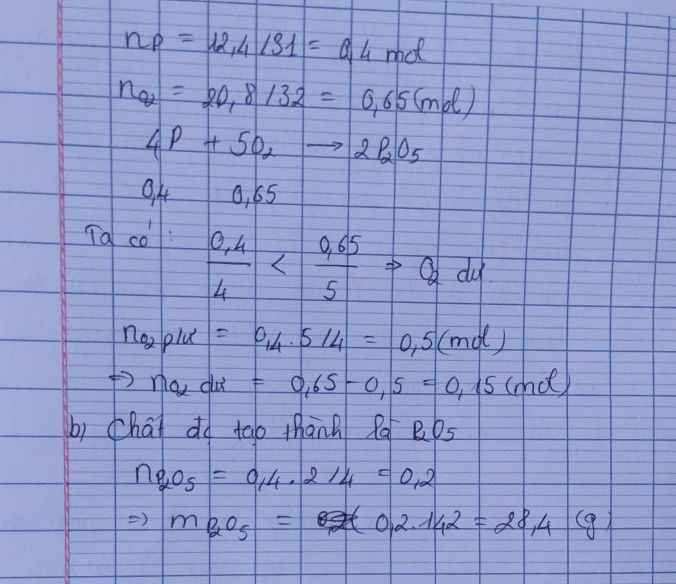
b2
bài 2
số mol S và O là :
ns=24\32=0,75(mol)
nO2=26\16.2=0,8125(mol)
pthh S+O2to→SO2
(ns(đề)\ns(pt))=0,751<(nO2(đề)\nO2(pt))=0,8125
=>tính theo S=>O dư =>S p/ứng hết
chất tạo thành là SO2
mSO2=nSO2.MSO2=0,75.(32+16.2)=48(g)
bài 3
số mol Fe và O là :
nFe=22,4\56=0,4(mol)
nO2=2,24\22,4=0,1(mol)
pthh 3Fe+2O2to→Fe3O4
nFe(đề)\nFe(pt)=0,43>nO2(đề)\nO2(pt)=0,12
=>tính theo O=>Fe dư =>O p/ứng hết
chất tạo thành là Fe3O4
mFe3O4=nFe3O4.MFe3O4=0,05.(56.3+16.4)=11.6(g)
b4
nCH4=3.36/22.4=0.15 (mol)
nO2=2.24/22.4=0.1 (mol)
PTPU: CH4+2O2->CO2+2H2O (nhiệt độ t)
Xét:
nCH4/1=0.15/1=0.15
nO2/2=0.1/2=0.05
Vì 0.15>0.05 nên O2 hết CH4 dư.
Vì vậy ta tính theo O2
...
Chất tạo thành CO2 và H2O
Theo PT ta có:
nCH4=nCO2=0.15 (mol) => mCO2=0.15.44=6.6(g)
nO2=nH2O=0.1 (mol) => mH2O=0.1.18=1.8 (g)
b6
4Al + 3O2 ==nhiệt độ==> 2Al2O3
nAl=21,6/27=0,8 (mol)
nO2=13,44/22,4= 0,6 (mol)
Ta có tỉ số:
0,8/4 = 0,6/3
Vậy cả 2 chất đều phản ứng hết.
Chất tạo thành là Al2O3
nAl2O3=1/2nAl=(1/2).0,8=0,4 (mol)
==> mAl2O3=0,4.102=40,8 (g)
b7
C2H2+5/2O2--------->2CO2+H2O
a) n C2H2=3,36/22,4=0,15(mol)
n O2=6,72/22,4=0,3(mol)
Lập tỉ lệ
0,15\1>0,3:5\2
---> C2H2 dư
Theo pthh
n C2H2=2/5 n O2=0,12(mol)
n C2H2 dư=0,15-0,12=0,03(mol)
m C2H2 dư=0,03.26=0,78(g)
b) Chất tạo thành là CO2 và H2O
c) Theo pthh
n CO2=4/5 n O2=0,24(mol)
m CO2=0,24.44=10,56(g)
n H2O=2/5n O2=0,12(mol)
m H2O=0,12.28=2,16(g)
b8
nC=19000.96%\12=1520(mol)
nO2=2240.(1\5)\22,4=20(mol)
PTHH: C + O2 to--> CO2
Xét tỉ lệ: 1520\1>20\2 => C dư, O2 hết