Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A có thể là : HCl
B có thể là : SiO2
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\)
A: NaOH, B: Fe3O4
\(2NaOH+Al_2O_3->2NaAlO_2+H_2O\)
\(2NaOH+SiO_2->Na_2SiO_3+H_2O\)

+ Dung dịch X có thể là dd axit : VD dd HCl ⇒ Y là SiO2
PTHH:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
+ Dung dịch X có thể là dd bazơ mạnh: VD: NaOH đặc ⇒ Y là Fe2O3
PTHH:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
SiO2 + 2NaOH ----đặc,to→ Na2SiO3 + H2O

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
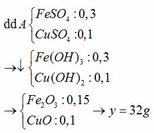

Hỗn hợp khí gồm CO2, SO2 và C2H4 gồm có 2 oxit axit tác dụng được với kiềm và 2 chất có thể tác dụng với brom trong dung dịch nên khi cho hỗn hợp vào dung dịch chứa một chất tan A, thì còn lại một khí B đi qua dung dịch sẽ có hai trường hợp:
- Trường hợp 1: Chất A là kiềm thì 2 oxit axit phản ứng và bị giữ lại trong dung dịch kiềm, còn lại khí B là C2H4 không phản ứng và đi qua dung dịch kiềm.
Các PTHH: CO2 + 2NaOH ---> Na2CO3 + H2O SO2 + 2NaOH ---> Na2SO3 + H2O
- Trường hợp 2: Chất A là dung dịch nước brom, hai chất phản ứng được và bị giữ lại trong dung dịch là SO2 và C2H4 còn khí B là CO2 không phản ứng và đi qua dung dịch.
Các PTHH:
SO2 + Br2 + 2H2O ---> 2HBr + H2SO4
C2H4 + Br2 ---> C2H4Br2

Đặt \(n_{K_2O}=n_{CuO}=n_{Fe_3O_4}=n_{Al_2O_3}=1\left(mol\right)\)
=> \(n_{hh}=4\left(mol\right)\)
- Cho hỗn hợp + CO dư :
\(CO+CuO-^{t^o}\rightarrow Cu+CO_2\)
\(4CO+Fe_3O_4-^{t^o}\rightarrow3Fe+4CO_2\)
=> Khí B là CO2 (5 mol) và CO dư
A gồm K2O (1 mol) ,Al2O3 (1 mol) , Fe (3 mol), Cu (1 mol)
- Cho A + H2O dư
\(K_2O+H_2O\rightarrow2KOH\)
\(2KOH+Al_2O_3\rightarrow2KAlO_2+H_2O\)
=> Dung dịch C : KAlO2 (2 mol)
Phần không tan D : Fe (3 mol) , Cu (1 mol)
- Cho D + AgNO3
\(n_{AgNO_3}=2n_{hhbandau}=8\left(mol\right)\)
\(2AgNO_3+Fe\rightarrow2Ag+Fe\left(NO_3\right)_2\)
\(2AgNO_3+Cu\rightarrow2Ag+Cu\left(NO_3\right)_2\)
=> \(n_{AgNO_3\left(pứ\right)}=3.2+1.2=8\left(mol\right)\) => AgNO3 phản ứng hết
=>Dung dịch E gồm : Fe(NO3)2 (1 mol) , Cu(NO3)2 (1 mol)
Chất rắn F gồm : Ag (8 mol)
- Khí B : CO2 (5 mol) và CO dư sục qua dung dịch C KAlO2 (2 mol)
\(KAlO_2+CO_2+2H_2O\rightarrow Al\left(OH\right)_3+KHCO_3\)
=> Dung dịch H : KHCO3
Kết tủa I : Al(OH)3
(Làm bài này xong tui muốn tắt thở luôn =))))) Chúc em học tốt nha <3 ))

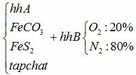
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
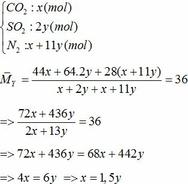
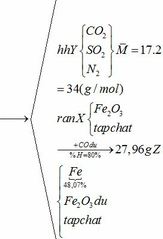
Khối lượng Fe có trong Z là:
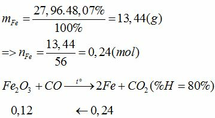
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
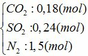
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
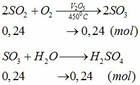
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
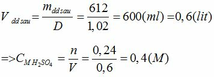
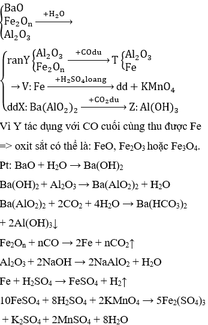
- A có thể là dung dịch kiềm, kiềm thổ (LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2). Khi đó chất rắn B là Fe3O4
PTHH ví dụ:
\(2NaOH+Al_2O_3\rightarrow2NaAlO_2+H_2O\)
\(SiO_2+2NaOH\rightarrow Na_2SiO_3+H_2O\)
- A có thể là dung dịch axit (HCl, \(H_2SO_4\),...). Khi đó chất rắn B là \(SiO_2\)
PTHH ví dụ:
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\)