Cho sơ đồ phản ứng sau:
Propen X Y Z Glixerol trinitrat.
Vậy X, Y, Z là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có:
x là hóa trị của SO4==> x= 2
y là hóa trị của Fe==> y =3 hoặc y=2
Do x, y khác nhau
=> y=3
Vậy ta có phương trình phản ứng
2Fe(OH)3+ 3H2SO4 -> Fe2(SO4)3 + 6H2O

1.
\(Ca+2H_2O-->Ca\left(OH\right)_2+H_2\)
\(n_{Ca}=\dfrac{4}{40}=0,1\left(mol\right)\)
Cứ 1 mol Ca phản ứng thì khối lượng tăng 34(g)
0,1_____________________________ x
=>x=0,1.34=3,4(g)
mà đề cho tăng 3,9 gam
=> khối lượng tăng = khối lượng H2 thoát ra
=>mH2 =3,9-3,5=0,4(g)=>\(n_{H_2}=0,4:2=0,2\left(mol\right)\)
=>\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Câu 2 : Bột sắt là một loại hóa chất công nghiệp rất độc, được ứng dụng nhiều trong việc nhuộm màu, tẩy rửa mạch điện tử,…Bột sắt có CTHH là FeCl3

\(Fe2O3+3H2-->2Fe+3H2O\)
b) \(n_{Fe2O3}=\frac{16}{160}=0,1\left(mol\right)\)
\(n_{H2}=\frac{8}{2}=4\left(mol\right)\)
\(\frac{4}{3}>\frac{0,1}{1}\Rightarrow H2\) dư
\(n_{H2}=3n_{Fe2O3}=0,3\left(mol\right)\)
\(n_2dư=4-0,3=3,7\left(mol\right)\)
\(m_{H2}dư=3,7.2=7,4\left(g\right)\)
c) \(n_{Fe}=2n_{Fe2O3}=0,2\left(mol\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
d) n\(_{H2O}=3n_{Fe2O3}=0,3\left(mol\right)\)
Số phân tử H2O = \(0,3.6.10^{23}=1,8.10^{23}\) (phân tử)

Câu 2:
a) Các chất tác dụng với nước: SO3, P2O5, K2O, BaO, K, Mn2O7
Pt: SO3 + H2O --> H2SO4
......P2O5 + 3H2O --> 2H3PO4
......K2O + H2O --> 2KOH
......BaO + H2O --> Ba(OH)2
......2K + 2H2O --> 2KOH + H2
......Mn2O7 + H2O --> 2HMnO4
b) Các chất tác dụng với H2: Mn2O7, CuO
Pt: Mn2O7 + 7H2 --to--> 2Mn + 7H2O
.....CuO + H2 --to--> Cu + H2O
c) Các chất tác dụng với O2: Ag, Fe, CH4, K
Pt: 2Ag + O2 --to--> 2AgO
......3Fe + O2 --to--> Fe3O4
......CH4 + 2O2 --to--> CO2 + 2H2O
......4K + 2O2 --to--> 2K2O
Câu 5:
Gọi CTTQ của A: CaxCyOz
Ta có: \(x:y:z=\dfrac{40}{40}:\dfrac{12}{12}:\dfrac{48}{16}=1:1:3\)
Vậy CTHH của A: CaCO3
A: CaCO3:
B: CaO
C: CO2
D: Ca(OH)2
Pt: CaCO3 --to--> CaO + CO2
...............................(B)......(C)
......CaO + H2O --> Ca(OH)2
......(B).........................(D)
......CO2 + Ca(OH)2 --> CaCO3 + H2O
.......(C)........(B)...............(A)

Bạn tự cân bằng nhé![]()
1/O2+H2->H2O
Cu+O2->CuO
CaO+H2O->Ca(OH)2
2/O2->H2O->NaOH->NaCl
O2+H2->H2O
H2O+ Na->NaOH+ H2
NaOH+ HCl->NaCl+H2O
3/nH2=6,72/22,4=0,3mol
2Na+2H2O->2NaOH+H2
0,6 0,6 0,6 0,3 mol
mNa=0,6*23=13,8g

Câu 1:
a. Quy tắc hóa trị: \(a\times x=b\times y\)
b. Gọi hóa trị của C là a
Áp dụng QTHT : \(a\times x=b\times y\)
ta có: \(a.1=II.2\Rightarrow a=\dfrac{II.2}{1}=IV\)
Vậy Cacbon có hóa trị IV
c. Gọi CTHH là: \(Al_x\left(SO_4\right)_y\)
Ta có: Al (III) và \(SO_4\left(II\right)\)
Theo QTHT: \(III\times x=II\times y\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy CTHH của hợp chất là: \(Al_2\left(SO_4\right)_3\)
Câu 2:
a) 2Mg + O2 \(\underrightarrow{to}\) 2MgO
b) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{Mg}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,2\times40=8\left(g\right)\)
c) \(n_{O_2}=\dfrac{3,26}{22,4}=\dfrac{163}{1120}\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Mg}\)
Theo bài: \(n_{O_2}=\dfrac{163}{224}n_{Mg}\)
Vì \(\dfrac{163}{224}>\dfrac{1}{2}\) ⇒ O2 dư
Theo pT: \(n_{O_2}pư=\dfrac{1}{2}n_{Mg}=\dfrac{1}{2}\times0,2=0,1\left(mol\right)\)
\(\Rightarrow n_{O_2}dư=\dfrac{163}{1120}-0,1=\dfrac{51}{1120}\left(mol\right)\)
\(\Rightarrow m_{O_2}=\dfrac{51}{1120}\times32=1,457\left(g\right)\)

\(C_xH_yO_z+\left(x+\frac{y}{4}-\frac{z}{2}\right)O_2->xCO_2+\frac{y}{2}H_2O\)
Tham khảo nhé~
Sai sót xin bỏ qua~~~

Câu 1:
Đặt CT cần tìm là R:
PTHH:
\(4R+O_2-to->2R_2O\)
\(n_R\left(1\right)=\dfrac{14,82}{R}\left(mol\right)\)
\(n_{O_2}=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Theo PTHH :
\(n_R\left(1\right)< 4n_{O_2}=4.0,2=0,8\left(mol\right)=>n_R\left(1\right)< 0,8\left(I\right)\)
\(n_R\left(2\right)=\dfrac{15,99}{R}\left(mol\right)\)
Theo PTHH:
\(n_R\left(2\right)>4n_{O_2}=40,2=0,8\left(mol\right)=>n_R\left(2\right)>0,8\left(II\right)\)
Từ (I) và( II) Suy ra :
\(\dfrac{14,82}{R}< 0,8< \dfrac{15,99}{R}\)
Gỉai cái này là ra R
Câu 2:
\(2xR+yO_2-->2R_xO_y\)
\(n_R=\dfrac{5,4}{R}\left(mol\right)\)
\(n_{R_xO_y}=\dfrac{10,2}{Rx+16y}\left(mol\right)\)
Theo PTHH :
\(n_R=xn_{R_xO_y}< =>\dfrac{5,4}{R}=\dfrac{x.10,2}{Rx+16y}\)
<=> \(5,4.\left(Rx+16y\right)=10,2Rx\)
<=> \(5,4Rx+86,4y=10,2Rx\)
<=>\(4,8Rx=86,4y\)
=> \(R=\dfrac{86,4.y}{4,8x}=\dfrac{18.y}{x}=\dfrac{9.2y}{x}\)
Đặt \(\dfrac{2y}{x}=n\) là hóa trị của R
Vì R là kl nên sẽ có 4 hóa trị thay lần lượt vào ta thấy n=3 là thỏa mãn => R là Al
Câu 3:
PTHH:
FexOy + (6x-2y)HNO3 ---> xFe(NO3)3 + (3x-2y)NO2 + (3x-y)H2O
\(n_{NO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PTHH:
\(n_{Fe_xO_y}=\dfrac{1}{3x-2y}n_{NO_2}=\dfrac{1}{3x-2y}.0,1\left(mol\right)\)
=>\(M_{Fe_xO_y}=23,2:\dfrac{0,1}{3x-2y}\)
=> 56x+16y=\(\dfrac{23,2.\left(3x-2y\right)}{0,1}\)
=> \(5,6x+1,6y=23,2\left(3x-2y\right)\)
=> 5,6x+1,6y=69,6x-46,4y
=> 48y=64x=> \(\dfrac{x}{y}=\dfrac{48}{64}=\dfrac{3}{4}\)
=>CTHH của oxit sắt là : \(Fe_3O_4\)
1. Gọi R là kim loại ( I )
\(n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(PTHH:4R+O_2\underrightarrow{t^o}2R_2O\)
\(\dfrac{14,82}{M_R}->\dfrac{3,105}{M_R}\left(mol\right)\)
Theo đề, ta có : \(\dfrac{3,705}{M_R}< 0,1\)
=> 3,075 < 0,1 MR => M
\(PTHH:4R+O_2\underrightarrow{t^o}2R_2O\)
0,4 <- 0,1 (mol)
Theo đề : 0,4 MR < 15,99
=> M2 < \(\dfrac{15,99}{0,4}\) < 39,375 (2)
Từ (1), (2) => 37,05 MR < 39,975
=> R thuộc nguyên tố Kali (I)

a) \(2C_6H_6+15O_2\underrightarrow{t^o}12CO_2+6H_2O\)
b) \(n_{C6H6}=\frac{7,8}{78}=0,1\left(mol\right)\)
\(2C_6H_6+15O_2\underrightarrow{t^o}12CO_2+6H_2O\)
0,1_______0,75__0,6_______0,3(mol)
\(m_{CO2}=0,6.44=26,4\left(g\right)\)
\(m_{H2O}=0,3.18=5,4\left(g\right)\)
a) C6H6 + 15/2O2 -----> 6CO2 + 3H2O
b) n C6H6=7,8/78=0,1(mol)
Theo pthh
n CO2=6n C6H6=0,6(mol)
m CO2=0,6.44=26,4(g)
n H2O=3n C6H6=0,3(mol)
m H2O=0,3.18=5,4(g)
Đáp án B
Các phương trình phản ứng xảy ra như sau:
CH2 = CH – CH3 + Cl2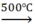 CH2 = CH – CH2Cl + HCl
CH2 = CH – CH2Cl + HCl
CH2 = CH - CH2Cl + Cl2 + H2O à CH2Cl – CHOH – CH2Cl + HCl
CH2Cl – CHOH – CH2Cl + NaOH à CH2OH – CHOH – CH2OH + 2NaCl