Có các chất bột màu trắng: . Có thể dùng hóa chất nào sau đây để nhận biết từng chất?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


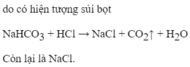

Có 2 chất bột trắng CaO và Al2O3 thuốc thử để phân biệt được 2 chất bột là
A. dung dịch HCl. B. NaCl.
C. H2O. D. giấy quỳ tím.

Ta trích mỗi chất làm mẫu thử :
Dùng quỳ tím ẩm để nhận biết :
- Mẫu thử nào làm quỳ tím ẩm hóa xanh là Ba(OH)2( ban đầu có chứa BaO) và NaOH ( ban đầu có chứa Na2O)
- Mẫu thử nào làm quỳ tím ẩm hóa đỏ là H3PO4 ( ban đầu có chứa P2O5)
- Mẫu thử nào không làm quỳ tím ẩm đổi màu thì đó là MgO
Để nhận biết BaO và Na2O thì ta cho 2 mẫu thử tác dụng với CO2 , mẫu thử nào tạp ra kết tủa thì đó là BaO , mẫu thử nào không có kết tủa , các chất tan hết thì đó là Na2O
PTHH :
BaO + CO2 \(\rightarrow\) BaCO3 \(\downarrow\)
Na2O + CO2 \(\rightarrow\) Na2CO3
lấy mỗi lọ trên một ít hóa chất đễ làm mẫu thử hòa tan các lọ trên vào nước sau đó cho quỳ tím vào nếu
quỳ tím hóa đỏ => P2O5 pt p2o5+3h2o--> 2h3po4
- nếu quỳ tím hóa xanh => BaOvà Na2O cho dd này tác dụng với H2SO4 nấu tạo kt trắng ==> BaO
pt : BaO+2H2O->Ba(OH)2+H2O
Na2O+2H2O -> 2NaOH+H2O
Ba(OH)2+H2SO4-> BaSO4+2H2O
nếu không tan => MgO

Lấy 1 một ít mẫu chất trên để thử
cho tất cả các chất vào H2O không tan là MgO
tạo thành kết tủa trắng là CaO
2 chất còn lại cho vào quỳ tím nếu làm quỳ tím hóa xanh là Na2O
quỳ tím hóa đỏ là P2O5
Cho tất cả các chất trên tác dụng với nước , không tan là MgO , tan tạo thành dd vẫn đục là CaO .Cho qtím vào 2dd còn lại , làm qtím hóa xanh là Na2O , đỏ là P205.
PTHH :
CaO + 2H20 -----> Ca(OH)2 (dd đục) +H20
Na2O+ 2H20 ----> 2NaOH + H20
P2O5 + 3H20 ---> 2H3PO4

Cho 3 chất bột trên tác dụng với nước
PTHH:
CaO + H2O -> Ca(OH)2
P2O5 + 3H2O -> 2H3PO4
NaCl + H2O -> không p/ứ
Cho giấy quỳ tím vào các dd vừa thu được
+) Chất nào làm quỳ tím chuyển sang màu xanh là Ca(OH)2 => Cao
+) Chất nào làm quỳ tím chuyển sang màu đỏ là H3PO4 => P2O5
Chất còn lại là NaCl
-Cho nước vào
CaO+H2O---->Ca(OH)2
P2O5+3H2O---->2H3PO4
- Cho QT vào các dd Ca(OH)2, H3PO4 và NaCl
+Làm QT hóa đỏ là H3PO4
---.chất ban đầu là P2O5
+Làm QT hóa xanh là Ca(OH)2
--->Chất bđ là CaO
+K làm đổi màu QT là NaCl

làm ơn trả lời nhanh giùm mik mik cần cái này để làm tư liệu nộp cho cô![]()
Câu 1 :
Dùng miệng nếm thử là cách đơn giản nhất :
- Chất có vị ngọt là đường trắng
- Chất có vị mặn là muối ăn .
Câu 2 :
Ngửi qua 3 lọ thấy lọ có mùi hơi chua là giấm .
Sau đó nếm thử hai chất trong hai lọ còn lại
- Lọ có vị ngọt - > đường ăn
- Lọ có vị mặn - > muối ăn

Trích mẫu thử
Cho H2O vào các mẫu thử rồi cho quỳ tím vào
P2O5+3H2O--->2H3PO4(Quỳ tím hóa đỏ)
CaO+H2O--->Ca(OH)2(Quỳ tím hóa xanh)
KClO3+H2O--->KClO4+H2(có khí thoát ra)
NaCl: k hiện tượng

Bài 1:
a) - Điện phân nước:
2H2O --đp--> 2H2 + O2
Pt: 3Fe + 2O2 --to--> Fe3O4
......Fe3O4 + 4H2 --to--> 3Fe + 4H2O
b) - Trích mỗi chất một ít làm mẫu thử
- Cho nước vào các mẫu thử
+ Các mẫu tan gồm: CaO, P2O5, NaCl, Na2O
..............CaO + H2O --> Ca(OH)2
...............P2O5 + 3H2O --> 2H3PO4
...............Na2O + H2O --> 2NaOH
+ Mẫu không tan: MgO
- Nhúng quỳ tím vào các dd:
+ Mẫu làm quỳ tím chuyển sang màu xanh: Ca(OH)2, NaOH chất ban đầu là CaO, Na2O
+ Mẫu làm quỳ tím chuyển sang màu đỏ: H3PO4 chất ban đầu là P2O5
+ Mẫu không làm đổi màu quỳ tím là NaCl
- Dẫn CO2 từ từ vào 2 dd làm quỳ tím chuyển sang màu xanh
+ Mẫu xuất hiện kết tủa là Ca(OH)2 chất ban đầu là CaO
............Ca(OH)2 + CO2 --> CaCO3 + H2O
+ Mẫu còn lại là NaOH chất ban đầu là Na2O
............2NaOH + CO2 --> Na2CO3 + H2O
Bài 2:
A---t*--->B+O2
nO2=1,68/22,4=0,075(mol)
=>mO2=0,075.32=2,4(g)
Áp dụng định luật bảo toàn khối lượng:
mA=mB+mO2
=>mB=mA-mO2=15,15-2,4=12,75(g)
=>mO=12,75.37,65%=4,8(g)=>nO=4,8/16=0,3(mol)
mN=12,75.16,47%=2,1(g)=>nN=2,1/14=0,15(mol)
mK=12,75-4,8-2,1=5,85(g)=>nK=5,85/39=0,15(mol)
Gọi CTHH của B là :KaNbOc
Ta có: a:b:c=nK:nN:nO=0,15:0,15:0,3=1:1:2
===>CTĐG: KNO2
Gọi CTHH của A là: KxNyOz
Định luật bảo toàn nguyên tố:
mO2=4,8+2,4=7,2(g)
=>nO2=0,45(mol)
nN=0,15(mol)
nK=0,15(mol)
Ta có: x:y:z=nK:nN:nO=0,15:0,15:0,45=1:1:3
===>CTHH của A: KNO3

Câu 2:
a) Phương trình hóa học:
4FeCO3 + O2 \(\underrightarrow{^{to}}\) 2Fe2O3 + 4CO2
4FexOy + (3x-2y)O2 \(\underrightarrow{^{to}}\) 2xFe2O3
b) Khí A gồm CO2 và O2 dư
nBa(OH)2 = 0,4 . 0,15 = 0,06 mol
nBaCO3 = 7,88 : 197 = 0,04 mol
TH1: Ba(OH)2 còn dư
CO2 + Ba(OH)2 → BaCO3↓
0,04 ← 0,04 ← 0,04
nFeCO3 = nCO2 = 0,04 mol
mFexOy = mhh - mFeCO3 = 25,28 - 0,04 . 116 = 20,64(g)
nFe2O3 = 22,4 : 160 = 0,14 mol
Bảo toàn nguyên tố Fe: 2.nFe2O3 = nFeCO3 + nFe trong FexOy
→ nFe trong FexOy = 2.0,14 - 0,04 = 0,24 mol
mFexOy = mO trong FexOy + mFe trong FexOy
→ mO trong FexOy = 20,64 - 0,24 . 56 = 7,2
nO trong FexOy = 7,2 : 16 = 0,45 mol
Ta có: x : y = nFe : nO = 0,24 : 0,45 = 8 : 15
→ LOẠI
TH2: Ba(OH)2 hết
CO2 + Ba(OH)2 → BaCO3↓
0,04 ← 0,04 ← 0,04
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,04 ← 0,06-0,04
nCO2 = 0,04 + 0,04 = 0,08 mol
nFeCO3 = nCO2 = 0,08 mol
mFexOy = mhh - mFeCO3 = 25,28 - 0,08 . 116 = 16(g)
nFe2O3 = 0,14 mol
Bảo toàn nguyên tố Fe: 2.nFe2O3 = nFeCO3 + nFe trong FexOy
→ nFe trong FexOy = 2.0,14 - 0,08 = 0,2 mol
mFexOy = mO trong FexOy + mFe trong FexOy
→ mO trong FexOy = 16 - 0,2 . 56 = 4,8
nO trong FexOy = 4,8 : 16 = 0,3 mol
Ta có: x : y = nFe : nO = 0,2 : 0,3 = 2 : 3
→ Oxit: Fe2O3