Số mol, khối lượng chất, thể tích (đktc) của 9.1023 phân tử CO2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- nCO2 = \(\frac{9.10^{23}}{6.10^{23}}=1,5\left(mol\right)\)
- mCO2 = 1,5 x 44 = 66 (gam)
- VCO2(đktc) = 1,5 x 22,4 = 33,6 lít

a) nCO2=[(9.1023)/(6.1023)]=1,5(mol)
=> mCO2=1,5.44=66(g)
V(CO2,đktc)=1,5.22,4=33,6(l)
b) nH2=4/2=2(mol)
N(H2)=2.6.1023=12.1023(phân tử)
V(H2,đktc)=2.22,4=44,8(l)
c) N(CO2)=0,5.6.1023=3.1023(phân tử)
V(CO2,đktc)=0,5.22,4=11,2(l)
mCO2=0,5.44=22(g)
d) nN2=2,24/22,4=0,1(mol)
mN2=0,1.28=2,8(g)
N(N2)=0,1.1023.6=6.1022 (phân tử)
e) nCu=[(3,01.1023)/(6,02.1023)]=0,5(mol)
mCu=0,5.64=32(g)
Mà sao tính thể tích ta :3

\(a_1,m_{CaCO_3}=0,25.100=25(g)\\ a_2,m_{SO_2}=\dfrac{3,36}{22,4}.64=9,6(g)\\ a_3,m_{H_2SO_4}=\dfrac{9.10^{23}}{6.10^{23}}.98=147(g)\)

V C O 2 = n C O 2 . 22,4 = 0,25.22,4 = 5,6 (l)
V O 2 = n O 2 .22,4 = 0,25.22,4 = 5,6 (l)
n
N
2
=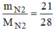 = 0,75(mol)
= 0,75(mol)
→ V N 2 = n N 2 .22,4 = 0,75.22,4= 16,8 (l)
n
C
O
2
=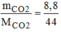 = 0,2 (mol)
= 0,2 (mol)
→ V C O 2 = n C O 2 . 22,4 = 0,2.22,4 = 4,48 (l)
n
H
2
=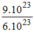 =1,5(mol)
=1,5(mol)
→ V H 2 = n H 2 . 22,4 = 1,5. 22,4 = 33,6 (l)
n
C
O
=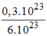 = 0,05(mol)
= 0,05(mol)
→ V C O = n C O . 22,4 = 0,05. 22,4 = 1,12 (l)

\(m_{CO_2}=12+16\cdot2=44\)
Số mol của CO2
\(n=\frac{m}{M}=\frac{11}{44}=0,25\)(mol)
Số mol của H2
\(n=\frac{sophantu}{6.10^{23}}=\frac{9.10^{23}}{6.10^{23}}=1,5\left(mol\right)\)
\(\Rightarrow\) VH2(đktc) =n.22,4=1,5.22,4=33,6(lít)
- nCO2 = 11 / 44 = 0,25 (mol)
- nH2 = \(\frac{9.10^{23}}{6.10^{23}}=1,5\left(mol\right)\)
=> VH2(đktc) = 1,5 x 22,4 = 33,6 lít

+ \(M_{CO_2}=12+16.2=44\left(\dfrac{g}{mol}\right)\)
\(n_{CO_2}=\dfrac{m}{M}=\dfrac{11}{44}=0,25mol\)
+ \(n_{H_2}=\dfrac{9.10^{23}}{6.10^{23}}=1,5mol\)
\(V_{H_2\left(đktc\right)}=n.22,4=1,5.22,4=33,6\left(l\right)\)

m H 2 = n H 2 . M H 2 = 12.2 = 24(g)
→ V H 2 = n H 2 .22,4 = 12.22,4 = 268,8(l)
m C O 2 = n C O 2 . M C O 2 = 0,05.44 = 2,2(g)
→ V C O 2 = n C O 2 . 22,4= 0,05.22,4= 1,12(l)
m C O = n C O . M C O = 0,01.28 = 0,28(g)
→ V C O = n C O .22,4 = 0,01.22,4 = 0,224(l)