giải chi tiết ra giùm mk luôn nha

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức hoá học của ôxit sắt cần tìm là: FexOy
- Theo đề bài ra ta có: 56x / 56x + 16y = 70%
<=> 5600x = 3920x + 1120y
<=> 1680x = 1120y
<=> x / y = 1120 / 1680
<=> x / y = 2 / 3
=> Công thức hoá học của ôxit sắt cần tìm là: Fe2O3


\(aaa=100a+10a+a=111a\)
Mà \(111⋮11\)nên \(111a⋮11\)hay aaa gạch đầu chia hết cho 11


a , [ ( - 3 ) + 4 ] + 2
= [ - 3 + 4 ] + 2
= 1 + 2
= 3
b , ( - 3 ) + ( 4 + 2 )
= - 3 + 6
= 3
a)\(\left[\left(-3\right)+4\right]+2\)
\(=1+2=3\)
b)\(\left(-3\right)+\left(4+2\right)\)
\(=\left(-3\right)+6\)
\(=3\)

Bạn nên đăng những câu khó nhất hoặc bạn lọc ra những câu tương tự nhau để bản thân có thể vận dụng nhé!

A, xin lỗi mk bị sai dấu, đây mới đúng nhé:
= \(8-4\sqrt{6}+3-\left(4-4\sqrt{6}+6\right)\)
= \(8-4\sqrt{6}+3-4+4\sqrt{6}-6\)
= 1
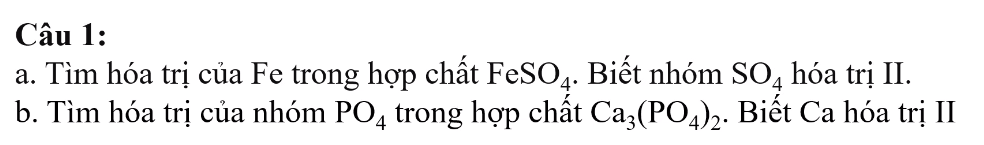


a)
$n_{Nito} = \dfrac{6,02.10^{23}}{6,02.10^{23}} = 1(mol)$
$m_{Nito} = 1.14 = 14(gam)$
b)
$n_{Cl} = \dfrac{6,02.10^{23}}{6,02.10^{23}} = 1(mol)$
$m_{Cl} = 1.35,5 = 35,5(gam)$
c)
$n_{H_2O} = \dfrac{6,02.10^{23}}{6,02.10^{23}} = 1(mol)$
$m_{H_2O} = 1.18 = 18(gam)$
a) \(n_{N_2}=\dfrac{6,02.10^{23}}{6,02.10^{23}}=1\left(mol\right)\)
=> \(m_{N_2}=1.28=28\left(g\right)\)
b) \(n_{Cl_2}=\dfrac{6,02.10^{23}}{6,02.10^{23}}=1\left(mol\right)\)
=> \(m_{Cl_2}=1.35,5.2=71\left(g\right)\)
c) \(n_{H_2O}=\dfrac{6,02.10^{23}}{6,02.10^{23}}=1\left(mol\right)\)
=> \(m_{H_2O}=1.18=18\left(g\right)\)
d) \(n_{CaCO_3}=\dfrac{6,02.10^{23}}{6,02.10^{23}}=1\left(mol\right)\)
=> \(m_{CaCO_3}=1.100=100\left(g\right)\)