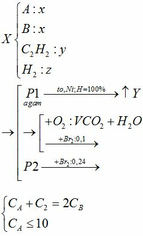
Cho 4,3 g hỗn hợp khí m gồm metan etilen axetilen qua bình đựng dung dịch brom dư thấy có 0,15 mol brom đã phản ứng. Mặt khác đốt cháy hoàn toàn 8,96 lít (điều kiện tiêu chuẩn) hỗn hợp m toàn bộ sản phẩm cháy được dẫn qua bình đựng h2 SO4 đặc dư thấy khối lượng bình axit tăng 12,6 gam . xác định thành phần phần trăm thể tích mỗi khí trong hỗn hợp m
Giúp em với ạ :<
Em cần gấp
Em cảm ơn ạ

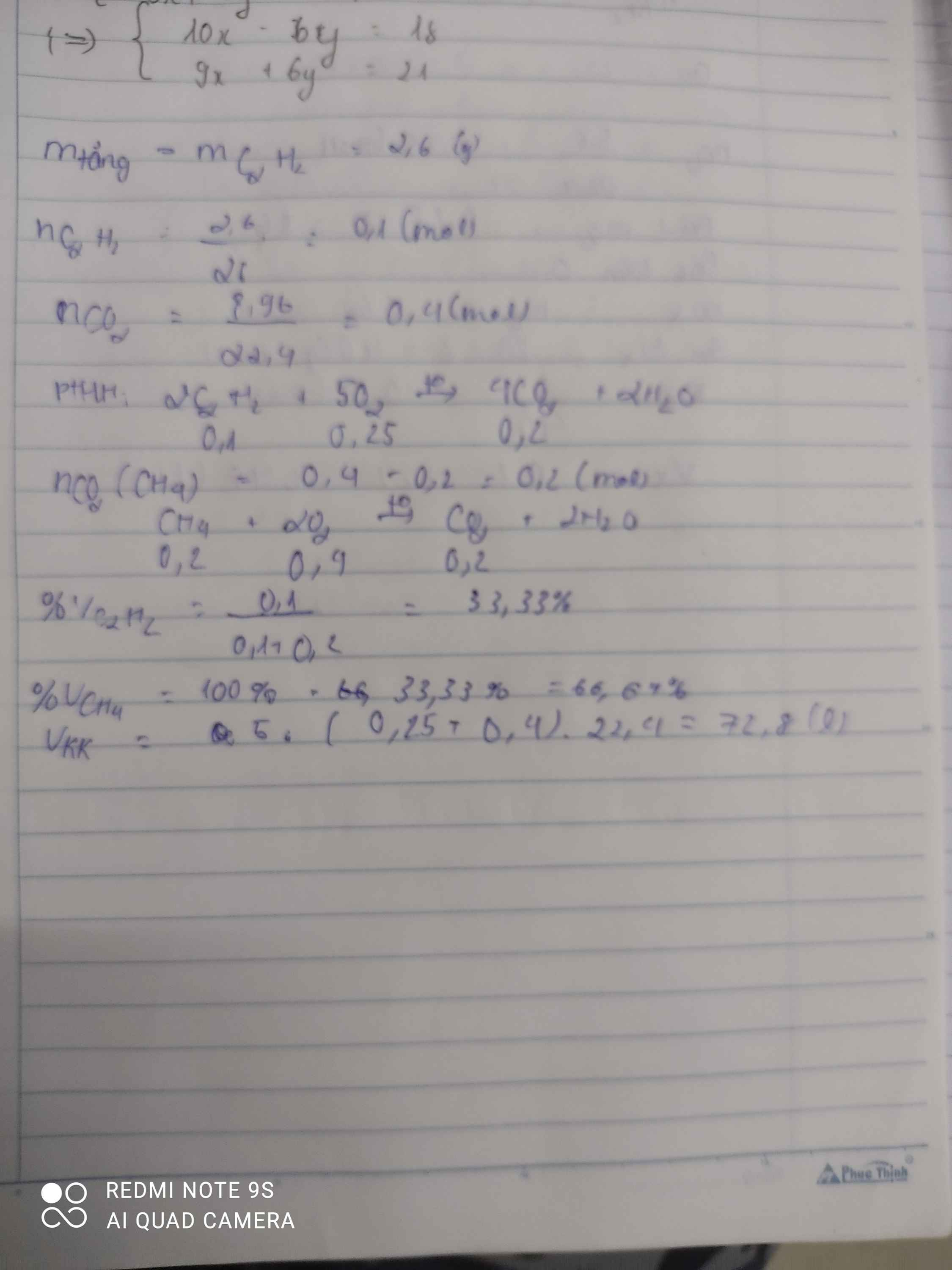


Gọi n CH4 = a(mol) ; n C2H4 = b(mol) ; n C2H2 = c(mol)
=> 16a + 28b + 26c = 4,3(1)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
n Br2 = b + 2c = 0,15(2)
Mặt khác :
m H2O = m tăng = 12,6 gam
=> n H2O = 0,7(mol)
n X = 8,96/22,4 = 0,4(mol)
Bảo toàn nguyên tố với H :
n H2O = 2n CH4 + 2n C2H4 + n C2H2
Ta có :
\(\dfrac{n_X}{n_{H_2O}} = \dfrac{a + b + c}{2a + 2b + c} = \dfrac{0,4}{0,7}(3)\)
Từ (1)(2)(3) suy ra a = 0,1 ; b = 0,05 ; c = 0,05
%V CH4 = 0,1/(0,1 + 0,05 + 0,05) .100% = 50%
%V C2H4 = %V C2H2 = 0,05/(0,1 + 0,05 + 0,05) .100% = 25%