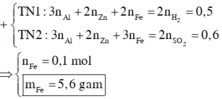Câu 5. Hòa tan hoàn toàn 10,4 gam hỗn hợp X gồm Zn và Fe trong dung dịch H2SO4 1M (được lấy dư), thu được 7,437 lít khí H2 (đkc). a. Tính số mol mỗi kim loại trong hỗn hợp X. b. Tính thể tích dung dịch H2SO4 đã tham gia phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\a, Đặt:n_{Fe}=a\left(mol\right);n_{Zn}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}56a+65b=14,9\\a+b=0,3\end{matrix}\right.\Leftrightarrow KQ.âm\)
Xem lại đề hộ anh em nha!

Fe+2HCl->FeCl2+H2
x-------------------------x mol
Zn+2HCl->ZnCl2+H2
y-------------------------y mol
=>Ta có hệ :\(\left\{{}\begin{matrix}56x+65y=14,9\\x+y=0,25\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\)
=>%m Fe=\(\dfrac{0,15.56}{14,9}.100=56,375\%\)
=>VHCl=\(\dfrac{0,15.2+0,1.2}{2}=0,25l=250ml\)

a) Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 7,35 (1)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a---->2a------->a------>a
Fe + 2HCl --> FeCl2 + H2
b------>2b----->b------>b
=> \(a+b=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
=> a + b = 0,12 (2)
(1)(2) => a = 0,07; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,07.65}{7,35}.100\%=61,9\%\\\%m_{Fe}=\dfrac{0,05.56}{7,35}.100\%=38,1\%\end{matrix}\right.\)
b) nHCl(dư) = 0,3.1 - 0,07.2 - 0,05.2 = 0,06 (mol)
PTHH: Ca(OH)2 + 2HCl --> CaCl2 + 2H2O
0,03<-----0,06
=> \(x=C_{M\left(ddCa\left(OH\right)_2\right)}=\dfrac{0,03}{0,1}=0,3M\)
c) Chất rắn thu được là Fe2O3
Bảo toàn Fe: \(n_{Fe_2O_3}=0,025\left(mol\right)\)
=> \(a=m_{Fe_2O_3}=0,025.160=4\left(g\right)\)
Kết tủa thu được là Fe(OH)2
Bảo toàn Fe: \(n_{Fe\left(OH\right)_2}=0,05\left(mol\right)\)
=> \(m=m_{Fe\left(OH\right)_2}=0,05.90=4,5\left(g\right)\)

Gọi số mol H2SO4 là a (mol)
Bảo toàn H: \(n_{H_2}=a\left(mol\right)\)
Có: \(m_{tăng}=m_{KL}-m_{H_2}\)
=> \(m_{KL}=48,6+2a\left(g\right)\)
Theo ĐLBTKL: \(m_{KL}+m_{H_2SO_4}=m_{Muối}+m_{H_2}\)
=> \(48,6+2a+98a=161,3+2a\)
=> a = 1,15 (mol)
=> \(a=\dfrac{1,15}{0,55}=\dfrac{23}{11}M\)

Đáp án A
Giả sử chỉ có Zn ⇒ nZn = 0,09 mol ⇒ nHCl = 0,18 ⇒ V = 180 ml
Nếu chỉ có Mg ⇒ nMg = 0,24 mol ⇒ nHCl = 0,48 ⇒ V = 480 ml
⇒ 180 ml < VHCl < 480 ml

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

2Al + 3H2SO4 →Al2(SO4)3 + 3H2 (1)
Zn + H2SO4 →ZnSO4 + H2 (2)
a;nH2=\(\dfrac{8,96}{22,4}\)=0,4(mol)
Đặt nAl=a
nZn=b
Ta có:
\(\left\{{}\begin{matrix}27x+65y=11,9\\1,5x+y=0,4\end{matrix}\right.\)
=>a=0,2;b=0,1
mAl=27.0,2=5,4(g)
%mAl=\(\dfrac{5,4}{11,9}.100\)=54,4%
%mZn=54,6%
Ta có kim loại + H2SO4 → muối + H2
nH2 = 0,4 mol
Bảo toàn nguyên tố H có nH2 = nH2SO4 = 0,4 mol
Bảo toàn khối lượng có mkim loại + mH2SO4 = mH2 + mmuối → 11,9 + 0,4.98 = 0,4.2 + m → m = 50,3