Hợp chất khí với H của nguyên tử nguyên tố R có công thức là RH4. Trong hợp chất axit cao nhất thì oxi chiếm 53,33%. Tìm khối lượng mol của R và tên R
Đang cần gấp ạ. Cảm ơn!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Hợp chất khí với Hiđro của một nguyên tố là R H 4 => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là R O 2 .
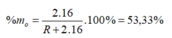
→ R = 28
Vậy R là Si (Silic).

Công thức oxit cao nhất là RO2
Có \(\dfrac{32}{M_R+32}.100\%=53,3\%=>M_R=28\left(Si\right)\)

Công thức hoá học các hợp chất với oxi và hiđro là CO 2 và CH 4

Giả sử có 1 mol A => mA = 1.60 = 60(g)
=> \(m_O=\dfrac{53,33.60}{100}=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTPT: CxHyO2
=> 12x + y + 32 = 60
=> 12x + y = 28
=> Chọn x = 2; y = 4
=> CTPT: C2H4O2

Nguyên tố R tạo thành hợp chất khí với hiđro có công thức là RH 4 sẽ tạo thành hợp chất oxit cao nhất là RO 2 có phần trăm khối lượng của nguyên tô R :
100% - 72,73% = 27,27%
72,73% phân tử khối của RO 2 ứng với 16 x 2 = 32 (đvC).
27,27% phân tử khối của RO 2 ứng với nguyên tử khối của nguyên tố R là :
32x27,27/72,73 = 12 (đvC) => R là cacbon (C)

a) Ta có: \(\dfrac{M_R}{M_R+32}\cdot100=46,67\) \(\Rightarrow M_R=28\)
Vậy R là Silic
b) Ta có: \(\dfrac{M_R}{M_R+4}\cdot100=87,5\) \(\Rightarrow M_R=28\)
Vậy R là Silic
Hợp chất khí với hidro của R là RH4, vậy R thuộc nhóm IVA.
Công thức oxit cao nhất của R là RO2.
Trong RO2, oxi chiếm 53,33% khối lượng. Ta có:
(16 x 2) / (R + 16 x 2) = 0.5333
32 / (R + 32) = 0.5333
32 = 0.5333R + 17.0656
0.5333R = 32 - 17.0656 = 14.9344
R = 14.9344 / 0.5333 ≈ 28
Vậy khối lượng mol của R là xấp xỉ 28 g/mol.
Nguyên tố có khối lượng mol gần bằng 28 là Silic (Si), có số nguyên tử khối là 28.
Do đó, R là Silic (Si).