Đốt cháy hoàn toàn 7,437 lít khí (đkc) hỗn hợp M gồm 2 hydrocarbon có các công thức tổng quát là CnH2n+2; CnH2n (đều là chất khí ở điều kiện thường), thu được 22 gam khí CO2 và 10,8 gam H2O.
a. Tính khối lượng hỗn hợp M đã bị đốt cháy và phần trăm về thể tích của mỗi hydrocarbon trong hỗn hợp M.
b. Xác định công thức phân tử của 2 hydrocarbon.

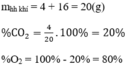

a, Ta có: \(n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
\(n_M=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
BTNT C và H: mM = mC + mH = 0,5.12 + 1,2.1 = 7,2 (g)
Ta có: nalkane = nH2O - nCO2 = 0,6 - 0,5 = 0,1 (mol)
⇒ nalkene = 0,3 - 0,1 = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_nH_{2n+2}}=\dfrac{0,1}{0,3}.100\%\approx33,33\%\\\%V_{C_nH_{2n}}\approx66,67\%\end{matrix}\right.\)
b, CTPT của alkane và alkene lần lượt là CnH2n+2 và CmH2m
BTNT C: 0,1.n + 0,2.m = 0,5
⇒ n = 1, m = 2 là thỏa mãn.
Vậy: CTPT cần tìm là C2H6 và C2H4
ô bài này khó quá nhỉ