86,3 : 23
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


86,3 * x + 13,7 * x = 100
( 86,3 + 13,7 ) * x = 100
100 * x = 100
x = 100 : 100
x = 1
nhé! Cảm ơn bạn nhiều!
86,3 * x +13,7 * x = 100
(86,3+13,7) * x =100
100 * x = 100
x = 100 : 100
x = 1.

Số mol các chất là:
![]()
![]()
![]()
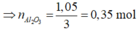
![]()
![]()
![]()
Gọi M là kim loại chung cho Na, K và Ba
Các phương trình phản ứng khi cho X tan hết trong H2O:
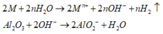
Dung dịch Y gồm Mn+, OH- dư và AlO2-
Dung dịch Y tác dụng với dung dịch HCl:
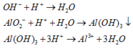
![]()
![]()
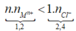 => dung dịch sau cùng gồm:
=> dung dịch sau cùng gồm: ![]()
Sơ đồ phản ứng:
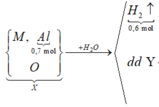
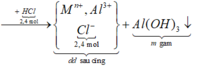
![]()
![]()
![]()
![]()
![]()
Đáp án B.

Đáp án A
![]()
Từ số mol H2 ta tính được số mol O H - (giải thích:
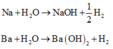
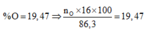
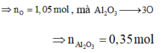
![]()
Ta có phương trình:
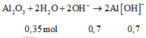
=> dung dịch Y gồm
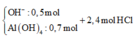
![]()
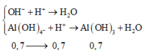
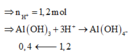
=> Số mol kết tủa còn lại là:
![]()

Ta có n O = 3n Al2O3 = 86,3. 19,46697567 /(100.16)= 1,05 mol
=>nAl2O3 =0,35 mol
Khi phản ứng với nước ta có dạng tổng quát: M + xH2O → M(OH)x + 0,5x H2
=> n OH =2 n H2 = 0,6 mol.2 = 1,2 mol
Al2O3 + 2OH- → 2AlO2- + 2H2O
=> Sau phản ứng thì n OH dư = 0,5 mol và n AlO2- = 0,7 mol
Khi cho 2,4 mol HCl thì
H+ + OH- → H2O
H+ +AlO2- + H2O → Al(OH)3
Al(OH)3 + 3 H+ → Al3+ + 3H2O
=> n Al(OH)3 =0,3 mol => m=0,3.78 = 23,4g
=>C


| GIẢI THÍCH THÊM |
| Số mol điện tích dương n+ mà tôi gọi trong lời giải thích là điện tích dương ứng với Na, K, Ba ta suy ra từ số mol H2. |

Giải thích:
mO(X)=86,3.19,47/100=16,8 gam=>nO(X)=1,05 mol=>nAl2O3=nO(X)/3=0,35 mol.
nOH-=2nH2=1,2 mol.
nHCl=3,2.0,75=2,4 mol.
Al2O3+2OH-→2AlO2- +H2O
0,35 0,7 0,7(mol)
Y gồm: 0,5 mol OH- dư, 0,7 mol AlO2-
H+ + OH-→H2O
0,5←0,5 (mol)
H+ + AlO2- + H2O→Al(OH)3↓
0,7←0,7→ 0,7 (mol)
Al(OH)3↓+3H+→Al3++3H2O
0,4←2,4-0,5-0,7=1,2 (mol)
nAl(OH)3=0,7-0,4=0,3 mol =>m↓=0,3.78=23,4 g.
Đáp án A

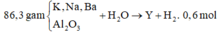



3,75 nhé