Hòa tan hoàn toàn 35,2 gam hỗn hợp M gồm hai muối bicarbonate của hai kim loại kiềm thuộc hai chu kì liên tiếp vào 438 gam dung dịch HCl 5%. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch
X và 8,96 lít CO2 (đktc).
a) Xác định tên hai kim loại kiềm.
b) Tính nồng độ phần trăm của các chất có trong dung dịch X.

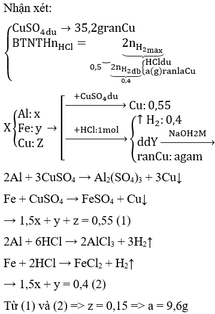
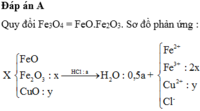
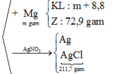
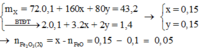
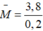 = 19
= 19 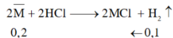
a, Ta có \(n_{CO_2}=0,4\left(mol\right)\)
\(n_{HCl}=0,6\left(mol\right)\)
→ \(HCO_3^-+H^+\rightarrow CO_2+H_2O\)
___________0,6______0,4 (mol)
→ HCl dư.
Gọi CT chung của M là AHCO3
⇒ nAHCO3 = nCO2 = 0,4 (mol)
\(\Rightarrow M_{AHCO_3}=\dfrac{35,2}{0,4}=88\)
⇒ MA = 27
Mà: 2 kim loại thuộc 2 chu kì liên tiếp nhau.
→ Na và K
b, Ta có: \(\left\{{}\begin{matrix}84n_{NaHCO_3}+100n_{KHCO_3}=35,2\\n_{NaHCO_3}+n_{KHCO_3}=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHCO_3}=0,3\left(mol\right)\\n_{KHCO_3}=0,1\left(mol\right)\end{matrix}\right.\)
nHCl (dư) = 0,6 - 0,4 = 0,2 (mol)
m dd sau pư = 35,2 + 438 - 0,4.44 = 455,6 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaHCO_3}=\dfrac{0,3.84}{455,6}.100\%\approx5,5\%\\C\%_{KHCO_3}=\dfrac{0,1.100}{455,6}.100\%\approx2,2\%\\C\%_{HCl}=\dfrac{0,2.36,5}{455,6}.100\%\approx1,6\%\end{matrix}\right.\)