Khi phân tích 4,854 gam A (chứa một oxide sắt và tạp chất trơ) nhận thấy mẫu có chứa 3,354 gam sắt. Tuy nhiên khi đun nóng cũng cùng khối lượng A trong môi trường có oxygen thì khối lượng mẫu thu được là 5,014 gam. Tìm công thức phân tử của oxide sắt và cho biết phần trăm tạp chất trơ có trong hỗn hợp giúp em câu này ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\\ n_{O_2}=\dfrac{2,479}{24,79}=0,1mol\\ 3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\\ \Rightarrow\dfrac{0,3}{3}>\dfrac{0,1}{2}\Rightarrow Fe.dư\\ 3Fe+2O_2\xrightarrow[t^0]{}Fe_3O_4\)
0,15 0,1 0,05
\(m_{Fe.dư}=16,8-0,15.56=8,4g\\ b.m_{Fe_3O_4}=0,05.232=11,6g\)

PTHH
Fe + 2HCl --->FeCl2 + H2
0.5==1======0.5====0.5
2H2 + 02 ---->2H20
0.5========0.5
nH20=0.5
nHCl=2 =>nHCl dư=1mol
PTHH:
10FeCl2 + 6KMnO4 + 24H2SO4 ----> 3K2SO4 + 5Fe2(SO4)3 + 6MnSO4 + 10Cl2 + 24H2O
0.25======0.15========================...
2KMnO4 + 16HCl --> 2MnCl2 + 5Cl2 + 2KCl + 8H2O
0.0625=====0.5===========0.15625
Cl2 + 2FeCl2 ----->2FeCl3
=====0.25======0.25
nKMn04=0.2125mol
VKMn04=0.425
mFeCl3=40.625g
Nếu sửa nồng độ HCl thành 0.65 :
nHCl dư=1.6 mol
2KMnO4 + 16HCl --> 2MnCl2 + 5Cl2 + 2KCl + 8H2O
0.1=======0.8
nKMn04=0.25 mol
=>VKMn04=0.5 (l)

Để giải nhanh bài này ta nên sử dụng đáp án để có được nhiều dữ kiện hơn, sẽ thấy các mắt xích amino axit chỉ có: Ala (89), Gly(75) và Phe(165), việc chúng ta cần làm là sắp xếp các mắt xích này để có được các đipeptit B và C thỏa mãn dữ liệu.


\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\\ n_{H_2}=3.0,1=0,3\left(mol\right)\\ a.V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b.m_{Fe}=0,2.\left(100\%-5\%\right).56=10,64\left(g\right)\)

Đáp án : D
Ta có : n CaCO3 = 20/100 = 0,2 mol
2FeCO3 + ½ O2 → (đk : t0) Fe2O3 + 2CO2 (1)
Dẫn hỗn hợp khí sau phản ứng vào dung dịch Ca(OH)2 thấy có kết tủa , đun phần nước lọc , lại xuất hiện kết tủa , chứng tỏ CO2 tác dụng với dung dịch Ca(OH)2 tạo 2 muối
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
0,2 0,2
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,4 0,2
=> tổng nCO2 = 0,4 + 0,2 = 0,6 mol
Theo phản ứng (1) : n FeCO3= nCO2 = 0,6 mol
=> % FeCO3 trong quặng xederit = 0,6.116 .100% / 116 = 60%

Đáp án C
Dung dịch X có chứa Cu2+ (x mol), H+ (y mol)![]()
Khối lượng thanh sắt giảm![]()
Khối lượng dung dịch giảm![]()
Từ (1), (2), (3) suy ra: a = 0,5


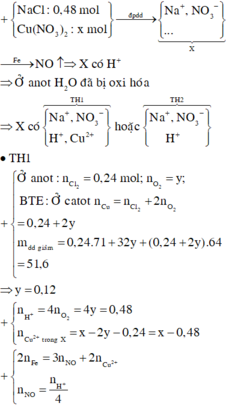
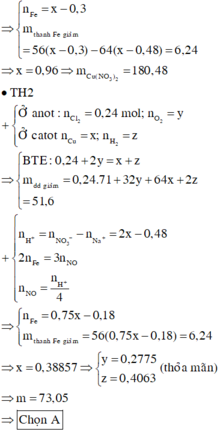

nFe = \(\dfrac{3,354}{56}\) = 0,06 mol
Khối lượng tăng lên sau khi phản ứng chính là khối lượng của oxygen
⇒ \(m_{O_2}\)= 5,014 - 4,854 = 0,16 gam
⇒ \(n_{O_2}\) = 0,005 mol
Sau phản ứng với oxygen dư, sắt sẽ đạt hóa trị cao nhất với công thức oxide là Fe2O3.
TH1: Giả sử oxide sắt ban đầu là FeO
2FeO + \(\dfrac{1}{2}\)O2 → Fe2O3
0,06 ---> 0,015
⇒ Không thỏa mãn.
TH2: Giả sử oxide sắt ban đầu là Fe3O4
nFe= 0,06 mol ⇒ \(n_{Fe_3O_4}\)= 0,02 mol
2Fe3O4 + \(\dfrac{1}{2}\)O2 → 3Fe2O3
0,02------->0,005
⇒ Thỏa mãn
Vậy công thức oxide ban đầu là Fe3O4.
\(m_{Fe_3O_4}\) = 0,02.232 = 4,64 gam
⇒ mtạp chất trơ = 4,854 - 4,64 = 0,214 gam
⇒ % Tạp chất trơ = \(\dfrac{0,214}{4,854}\). 100 = 4,408%