trộn 500ml dung dịch koh 1M với a lít dung dịch KOH 2M để được dung dịch KOH 1,2M. giá trị của a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
n H C l =1 V A ; n H N O 3 = 1 V A ; n H 2 S O 4 =1 V A → n H + =4 V A
n K O H = 1 V A ; n N a O H = 2 V B → n O H - = 3 V B
Để thu được dung dịch có pH= 7 thì n H + = n O H -
→ 4 V A = 3 V B → V A : V B = 3 : 4

Đáp án A
+ P h ả n ứ n g t ạ o m u ố i t r u n g h ò a k h i n O H - = n H + ⇒ V = 50 . 3 = 150 m l

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

Câu 5:
\(Đặt:V_{H_2O}=a\left(l\right)\left(a>0\right)\\ n_{KOH}=160.2,4=384\left(mol\right)\\ Vì:C_{MddKOH\left(cuối\right)}=2\left(M\right)\\ \Leftrightarrow\dfrac{384}{160+a}=2\\ \Leftrightarrow a=32\left(lít\right)\)
Vậy cần thêm 32 lít H2O

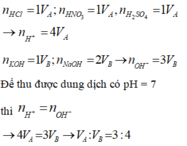
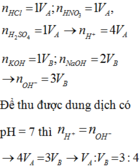

\(C_{M_{KOH}}=\dfrac{0.5\cdot1+2a}{0.5+a}=1.2\left(M\right)\)
\(\Leftrightarrow a=0.125\)
Ta có :
$V_{dd} = 0,5 + a(lít)$
$n_{KOH} = 0,5.1 + a.2 = 2a + 0,5(mol)$
Suy ra:
$C_{M_{KOH}} = \dfrac{2a + 0,5}{0,5 + a} = 1,2M$
$\Rightarrow a = 0,125(lít)$