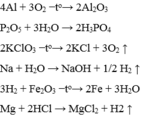Câu 1:a) cho sơ đồ phản ứng hóa học và hoàn thành các phương trình hóa học sau :
(1) ...+ O2 ---> AL2O3
(2) C + O2 ---> ...
b) cho iron (Fe) đã làm sạch vào 100 ml dung dịch copper (II) sulfate (CuSO4). nêu hiện tượng và viết phương trình hóa học xảy ra ?
c) đất nhiễm phèn có pH trong khoảng 4,5-5,0. Hãy giải thích vì sao trước khi vào mùa gieo sạ người ta thường bón vôi bột (CaO) để cải tạo loại đất này?
SOS!!!!!!!!!!!!!!!!!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 KClO 3 → t o 2 KCl + 3 O 2 2 O 2 + 3 Fe → t o Fe 3 O 4 Fe 3 O 4 + 4 H 2 → 3 Fe + 4 H 2 O Fe + 2 HCl → FeCl 2 + H 2 ↑

Câu 1 :
a) Xuất hiện tinh thể màu trắng NaCl
\(2Na+Cl_2\underrightarrow{^{^{t^o}}}2NaCl\)
b) Kẽm tan dần, dung dịch màu xanh lam nhạt dần xuất hiện chất rắn màu đỏ ( Cu )
\(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Câu 2 :
\(n_{Al}=\dfrac{2.7}{27}=0.1\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0.1...........................................0.15\)
\(V_{H_2}=0.15\cdot22.4=3.36\left(l\right)\)

a) \(n_{CuSO_4}=0,02.4=0,08\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_________0,08------>0,08---->0,08
Chất rắn A gồm Cu và Fe dư
dd B là FeSO4
b)
PTHH: Fe + 2HCl --> FeCl2 + H2
Khối lượng chất rắn còn lại sau phản ứng = mCu = 0,08.64 = 5,12 (g)
c)
PTHH: FeSO4 + 2NaOH --> Fe(OH)2 + Na2SO4
_______0,08--->0,16
=> \(V_{ddNaOH}=\dfrac{0,16}{2}=0,08\left(l\right)\)

Câu 1 :
\(a.Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{t^0}}FeCl_3\)
\(b.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(c.2H_2S+3O_{2\left(dư\right)}\underrightarrow{^{t^0}}2H_2O+2SO_2\)
\(d.2FeS+10H_2SO_{4\left(đ\right)}\underrightarrow{^{t^0}}Fe_2\left(SO_4\right)_3+9SO_2+10H_2O\)
Câu 2 :
Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa đỏ là H2SO4
- mẫu thử nào làm quỳ tím hóa xanh là Na2S
Cho dung dịch Bari clorua vào mẫu thử còn :
- mẫu thử nào tạo kết tủa trắng là MgSO4
\(BaCl_2 +MgSO_4 \to BaSO_4 + MgCl_2\)
- mẫu thử nào không hiện tượng gì là KCl

1.Có khí sinh ra:
\(Cu+2HCl\rightarrow CuCl_2+H_2\uparrow\)
2.Có kết tủa xuất hiện.
\(2KOH+CuSO_4\rightarrow Cu\left(OH\right)_2\downarrow+K_2SO_4\)
3.Kết tủa trắng.
\(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_4\downarrow\)

\(a,PTHH:CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\\ b,n_{CuSO_4}=\dfrac{80}{160}=0,5\left(mol\right)\\ \Rightarrow n_{KOH}=2n_{CuCO_4}=1\left(mol\right)\\ \Rightarrow V_{dd_{KOH}}=\dfrac{1}{1}=1\left(l\right)\\ c,n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,5\left(mol\right)\\ \Rightarrow m_{Cu\left(OH\right)_2}=0,5\cdot98=49\left(g\right)\)

a: 4Al+3O2->2Al2O3
b: Mg+CuSO4->MgSO4+Cu
c: Cu(OH)2+2HCl->CuCl2+2H2O
d: 2Fe(OH)3->Fe2O3+3H2O