Cho một loại chất béo có công thức cấu tạo sau:
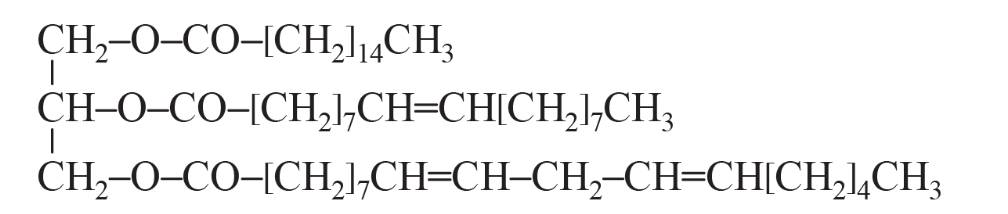
Viết phương trình hóa học của phản ứng giữa chất béo trên với hydrogen dư (xt, t, p) và với dung dịch potassium hydroxide.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
a) Công thức phân tử và công thức cấu tạo của phenol đơn giản nhất
CTPT: C6H5OH
b) Phenol phản ứng với dung dịch potassium hydroxide là phản ứng thế nguyên tử H của nhóm OH: tính acid.
PTHH: C6H5OH + KOH → C6H5OK + H2O
a: CTPT: \(C_6H_5OH\)
CTCT: 
b: Đây là phản ứng trung hòa
\(C_6H_5OH+KOH\rightarrow C_6H_5OK+H_2O\)

Phản ứng xà phòng hóa:
\(\left(C_{17}H_{33}COO\right)_3C_3H_5+3NaOH\xrightarrow[OH^-]{t^o}3C_{17}H_{33}COONa+C_3H_5\left(OH\right)_3\)
\(m_{C_{17}H_{33}COONa}=\dfrac{10\cdot72\%}{100\%}=7,2g\Rightarrow n_{C_{17}H_{33}COONa}=\dfrac{7,2}{304}=\dfrac{9}{380}mol\)
Theo pt: \(n_{chấtbéo}=\dfrac{n_{C_{17}H_{33}COONa}}{3}=\dfrac{\dfrac{9}{380}}{3}=\dfrac{3}{380}mol\Rightarrow m_{chấtbéo}=\dfrac{3}{380}\cdot884=6,98kg\)
\(n_{NaOH}=n_{C_{17}H_{33}COONa}=\dfrac{9}{380}mol\Rightarrow m_{NaOH}=\dfrac{9}{380}\cdot40=0,95kg=950g\)

Vì chất béo A khi thuỷ phân chỉ tạo ra hai muối của axit : Đó là C 17 H 35 COONa và C 15 H 31 COONa với tỉ lệ số mol tương ứng là 2 :1. Vậy este A chứa hai gốc axit C 17 H 35 COO- và một gốc axit C 15 H 31 COO- nên cấu tạo của este A là :


Chọn đáp án D
X là chết béo, các axit béo gồm axit stearic, oleic và linoleic.
Như vậy, phản ứng thủy phân chính là cái đầu tiên -COO- (triglixerin), tức là phản ứng với KOH, to.
Thêm nữa, chú ý vào 2 axit không no, nối đôi C=C chính là nơi mấu chốt
để xảy ra các phản ứng hóa học ở gốc hđc
Theo đó, nó có thể làm mất màu dung dịch Br2; làm no C=C bằng H2 (xt Ni, to).
► Note: ta biết dầu mỡ để trong không khí sẽ bị chuyển hóa: do O2 tấn công vào
nối đôi C=C tạo thành các peroxit có mùi khó chịu.
Vậy cả 4 TH đều có phản ứng xảy ra.

Giải thích:
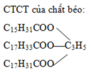
BTKL : mChất béo + mNaOH = mchất rắn + mC3H5(OH)3
Mà nC3H5(OH)3 = nCHẤT BÉO = 0,1 (mol)
=> mchất rắn = 0,1. 856 + 0,5. 40 – 0,1.92 = 96,4(g)
Đáp án D

a) \(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PTHH: HCl + KOH → KCl + H2O
Mol: 0,4 0,4 0,4
b) \(V_{ddKOH}=\dfrac{0,4}{1,5}=\dfrac{4}{15}\left(l\right)\approx0,267\left(l\right)\)
c) \(C_{M_{ddKCl}}=\dfrac{0,4}{0,2+\dfrac{4}{15}}=\dfrac{6}{7}M\approx0,857M\)