Gọi μ là số phân tử khí trong một đơn vị thể tích. Chứng tỏ rằng áp suất do các phân tử khí tác dụng lên thành bình được tính bằng công thức: \(p = \frac{1}{3}\mu m\overline {{v^2}} \).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: A
Xét ν mol khí, lượng khí này chứa số phần tử là N: N = ν. NA
NA là số A-vô-ga-đrô, NA = 6,02.1023 mol-1
Từ phương trình trạng thái ta được:
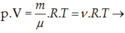
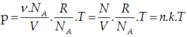


Đáp án C
X là C n H 2 n - 2 k O 2 ( k < 2, vì có một liên kết π ở chức).
C n H 2 n - 2 k O 2 + 3 n - k - 2 2 O 2 → nCO 2 + ( n - k ) H 2 O
Ta có
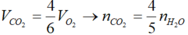
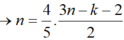
( vì MX < 100)
CTPT của X là: C4H8O2
CTCT là RCOOR’
RCOOR’ + KOH → RCOOK + R’OH
(mol) x → x x
nKOH (ban đầu) = 0,7.0,2 = 0,14 (mol)
mchất rắn = mmuối + mKOH dư= x(MR + 83) + (0,14 –x).56 = 12,88
⇒x.MR+27x =5,04
Biện luận tìm MR và x (với x < 0,14):
R là H => MR = 1 => x = 0,18 (loại)
R là CH3- => MR = 15 => x= 0,12 (nhận)
=> m = 0,12 . 74 = 8,88 (g)
R là C2H5 thì x = 0,09 ( nhận )
(1) đúng vì m =0,12.88=10,56 hoặc 0,09.88 =7,92(g)
(2) sai vì X chỉ có tên etyl axetat hoặc metyl propionat
(3) đúng vì mmuối = 0,12.98=11,76 hoặc m =0,09 .112=10,08
(4) đúng vì X cho 4 đồng phân este và 2 đồng phân axit
(5) đúng vì mancol = 0,12.46=5,52 hoặc 0,09.32=2,88 g

Chọn đáp án C
♦ giải đốt 1 , 76 g a m T + 0 , 075 m o l O 2 → t 0 7 C O 2 + 6 H 2 O
BTKL có m C O 2 + m H 2 O = 1 , 76 + 0 , 075 × 32 = 4 , 16 g a m
Giả thiết n C O 2 : n H 2 O = 7 : 6 → n C O 2 = 0 , 07 m o l ; n H 2 O = 0 , 06 m o l
bảo toàn có n O trong T = 0,05 mol
→ tỉ lệ n C : n H : n O = 7 : 12 : 5
→ CTPT của T là C 7 H 12 O 5 . Số O = 5; axit 2 chức có 4O
→ còn 1O của nhóm -OH ancol chưa phản ứng nữa mới đủ.
→ 2 ancol có cùng số C và 1 ancol đơn chức; 1 ancol còn lại hai chức.
ancol 2 chức, axit 2 chức thì phải từ C2 trở đi
→ 7 = 2 × 2 + 3
→ CTCT của T là C 2 H 5 O O C - C H 2 - C O O C H 2 C H 2 O H
→ 2 ancol là ancol etylic ( C 2 H 5 O H ) và etylen glicol ( C 2 H 4 ( O H ) 2 )

1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
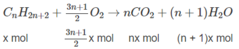
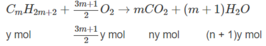
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
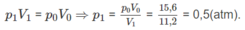
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
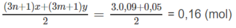
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
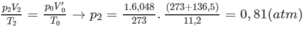
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 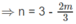
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.

a)

CxH2x +2 + (3x+1)/2O2 → t ∘ x CO2 + (x+1) H2O
CyH2y + 3y/2O2 → t ∘ y CO2 + y H2O
CzH2z-2 + (3z-1)/2O2 → t ∘ zCO2 + (z-1) H2O
Khi đốt cháy hỗn hợp A thu được CO2 và H2O. Cho sản phẩm qua Ca(OH)2 dư thì khối lượng bình tăng chính là khối lượng của H2O và CO2
=> mCO2 + mH2O = 9,56 (g)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 16/100 = 0,16 (mol)
=> nH2O = (9,56 – 0,16.44)/18 = 0,14 (mol)
Ta có hệ phương trình:
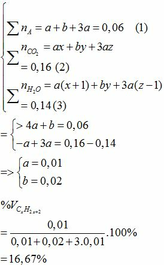
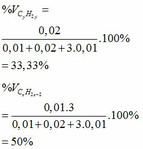
b)
thế a, b vào (2) => 0,01x + 0,02y + 3.0,01z = 0,16
=> x + y +3z = 16
Vì có 2 hidrocacbon bằng nhau và bằng một nửa số cacbon của hidrocacbon còn lại nên có các trường hợp sau:
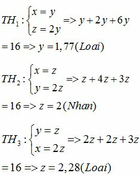
Vậy công thức phân tử của 3 hidrocacbon là: C2H6; C2H4 và C2H2

1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
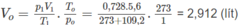
Số mol các chất trong bình trước phản ứng là:
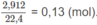
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
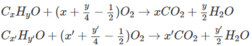
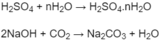
Số mol
H
2
O
là: 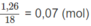
Số mol
C
O
2
là: 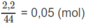
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
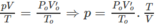
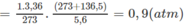
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.

Đáp án B
Có ![]()
Gọi công thức hidrocacbon A là ![]() và nA = a.
và nA = a.
Có phản ứng:
![]()
a ka a
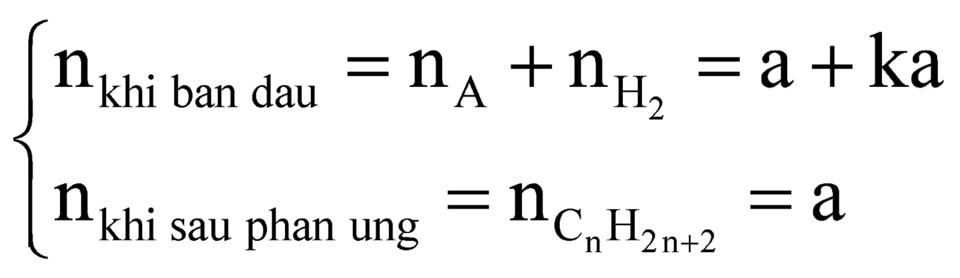
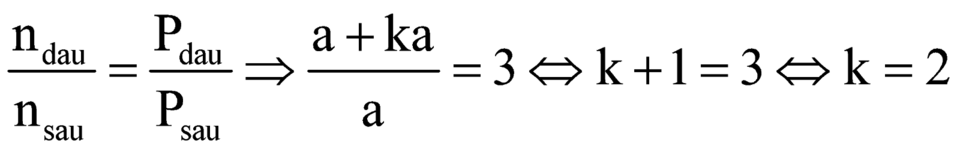
Mặt khác:
![]()
![]() .
.
Vậy A là C2H2.

ta có
\(\text{P1.V1=m/M.R.T (1) }\)
\(\text{P2.2V1=1/2.2m/M.R.T (2) }\)
lấy (1) chia (2) vế theo vế ta đc
\(\text{P1.V1/P2.2V1=1 }\)
\(\Rightarrow\text{P1.V1=P2.2V1 }\)
\(\Rightarrow\text{P1=2P2 }\)

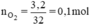
Vì A và O2 có cùng V ở cùng điều kiện nhiệt độ và áp suất nên nA = nO2 = 0,1 (mol)
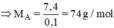
A là este no đơn chức nên có CTPT là CnH2nO2 (n ≥ 2)
Ta có: MCnH2nO2 = 14n + 32 = 74 ⇒ n = 3
→CTPT của A là: C3H6O2
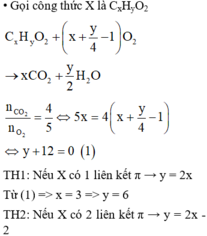


\(p = \frac{F}{S} = \frac{{\frac{N}{6}.f}}{S} = \frac{{\frac{{\mu Sv\Delta t}}{6}.\frac{{2mv}}{{\Delta t}}}}{S} = \frac{{\frac{1}{3}\mu m{v^2}S}}{S} = \frac{1}{3}\mu m{v^2}\)