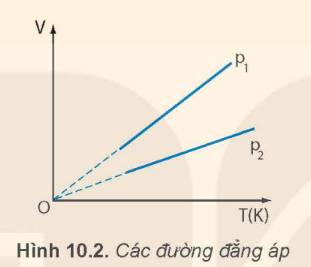
Ứng với các áp suất khác nhau của cùng một lượng khí, ta có những đường đẳng áp khác nhau. Hình 10.2 vẽ hai đường đẳng áp của cùng một lượng khí ứng với hai áp suất p1 và p2. Hãy so sánh p1 và p2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đồ thị được biểu diễn trên hình 122
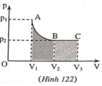
Nhận xét: Diện tích hình A V 1 V 2 B (phần gạch chéo) lớn hơn diện tích hình B V 2 V 3 C (phần nét chấm) nên công trong quá trình đẳng nhiệt ( A → B ) lớn hơn công trong quá trình đẳng áp ( B → C ).

Chọn D.
Khóa mở: p1 = pm = 105 Pa
Đối với bình 1 quá trình diễn ra trước khi K mở là quá trình đẳng tích.
![]()
Chênh lệch áp suất hai bên sau khi K mở: ∆p = 105 Pa
Bình 1 ban đầu: p0.V1 = ν.R.T0
Sau khi khóa K mở: (p + ∆p).V1 = ν1.R.T
Ở bình 2 sau khi K mở ta có: p.V2 = ν2.R.T
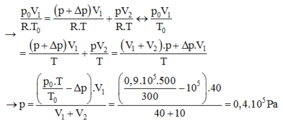
Mặt khác: ν = ν1 + ν2

Khi khóa K mở (bình đã thông nhau). Gọi p 1 ' và p 2 ' là áp suất riêng phần của chất khí thứ nhất và thứ hai.
Khi đó áp suất của hỗn hợp khí trong bình là:
p = p 1 ' + p 2 ' (1)
Xét chất khí trong bình A và B khi khóa K đóng và mở.
Theo định luật Bôi-lơ – Ma-ri-ốt ta có:
p 1 V 1 = p 1 ' ( V 1 + V 2 )
⇒ p 1 ' = p 1 V 1 V 1 + V 2 (2)
p 2 V 2 = p 2 ' ( V 1 + V 2 )
⇒ p 2 ' = p 2 V 2 V 1 + V 2 (3)
Thay (2) và (3) vào (1) ta được:
p = p 1 ' + p 2 ' = p 1 V 1 + p 2 V 2 V 1 + V 2
= 1 , 6.3 + 3 , 4.4 , 5 3 + 4 , 5 = 2 , 68 a t

Đáp án: B
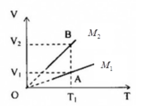
Vẽ đường thẳng qua T 1 , song song với trục OV, cắt đồ thị (V,T) của hai khí tại A p 1 , V 1 , T 2 và B p 1 , V 2 , T 1
Viết phương trình Cla-pe-rôn - Men-đê-lê-ép cho hai trạng thái, ta được:
p 1 V 1 = m M 1 R T 1 ( 1 ) p 1 V 2 = m M 2 R T 1 ( 2 )
Từ (1) và (2) suy ra: V 1 V 2 = M 2 M 1
Mặt khác, từ đồ thị, ta thấy: V 1 < V 2 ta suy ra M 2 < M 1
p1 > p2