Cho 3,36 lít (đktc) hỗn hợp khí gồm C2H2, CH4 tác dụng hết với dung dịch brom dư, lượng brom đó tham gia phản ứng là 16 gam. Tính phần trăm thể tích của mỗi khí trong hỗn hợp?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


C2H2+2Br2->C2H2Br4
0,05-----0,1
n Br2=\(\dfrac{16}{160}=0,1mol\)
=>%VC2H2=\(\dfrac{0,05.22,4}{3,36}100\)=33,3%
=>%VCH4=66,7%
Gọi số mol của \(C_2H_2\) và \(CH_4\) lần lượt là x và y.
\(C_2H_2+2Br_2\rightarrow CHBr_2+CHBr_2\)
x 2x
\(CH_4+Br_2\rightarrow CH_3Br+HBr\)
y y
Ta có hệ pt :
\(\left\{{}\begin{matrix}x+y=\dfrac{3,36}{22,4}\\2x+y=\dfrac{16}{160}\end{matrix}\right.\)
Giải hệ ta được : x = -0,05:))
coi lại đề mỗi cái đề cx đưa ko đàng hoàng nx.-.

C2H4+Br2->C2H4Br2
x----------x---------x
C2H2+2Br2->C2H2Br4
y--------2y------------y
=>\(\left\{{}\begin{matrix}x+y=\dfrac{0,896}{22,4}\\160x+320y=8\end{matrix}\right.\)
=>x=0,03 mol, y=0,01 mol
=>%VC2H4=\(\dfrac{0,03.22,4}{0,896}\).100=75%
=>%VC2H2=25%

Mạnh dạn đoán đây là Bài 5 trang 122 sgk Hóa lớp 9.
Đề bài bạn gửi bị thiếu một khí nữa là C2H4 đúng không?
Bạn xem lại đề bài nhé, nếu đúng là hỗn hợp khí gồm C2H2 và C2H4 thì mình giải như sau:
Gọi số mol của C2H4 và C2H2 lần lượt là x và y mol theo bài ra: x+y = 0,56/22,4 = 0,025 (mol)
(1) Pt: C2H4 + Br2 → C2H4Br2
x mol x mol x mol
C2H2 + 2 Br2 → C2H2Br4
y mol 2y mol y mol
Số mol n Br2 = x+2y = 5,6/160 = 0,035 9mol) (2)
Giải hệ (1) và (2) ta đc: x = 0,015 và y = 0,01
=> %V C2H4 = 0,015/0,025 = 60% ;
%V C2H2 = 40% (%V = % số mol ở cùng điều kiện)

\(Gọi : n_{C_2H_4} = a; n_{C_2H_2} = b\\ \Rightarrow a + b = \dfrac{5,6}{22,4} = 0,25(1)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ C_2H_2 + 2Br_2 \to C_2H_2Br_4\\ n_{Br_2} = a + 2b = \dfrac{56}{160} =0,35(2)\\ (1)(2)\Rightarrow a = 0,15 ; b = 0,1\\ \Rightarrow \%V_{C_2H_4} = \dfrac{0,15}{0,25} .100\% = 60\%\\ \%V_{C_2H_2} = 100\% -60\% = 40\%\)

a)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b)
Gọi số mol C2H2, C2H4 là a, b
=> \(a+b=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{Br_2}=\dfrac{22,4}{160}=0,14\left(mol\right)\)
PTHH:\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
a---->2a
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b--->b
=> 2a + b = 0,14
=> a = 0,04; b = 0,06
\(\left\{{}\begin{matrix}\%V_{C_2H_2}=\dfrac{0,04}{0,1}.100\%=40\%\\\%V_{C_2H_4}=\dfrac{0,06}{0,1}.100\%=60\%\end{matrix}\right.\)

Đáp án D
Đặt a, b, c lần lượt là số mol CH4, C2H4, C2H2 (trong 8,6 gam X)
Ta có: 16a + 28b + 26c = 8,6 (1)
b + 2c = 0,3 (2)
Mặt khác: Gọi số mol của CH4, C2H4, C2H2 trong 13,44 lít hỗn hợp X lần lượt là kx, ky, kz
![]() (3)
(3)
![]()
kc kc
Ta có
nkết tủa ![]() (4)
(4)
Lấy (3) chia (4) được
![]() (5)
(5)
Từ (1), (2) và (5) được

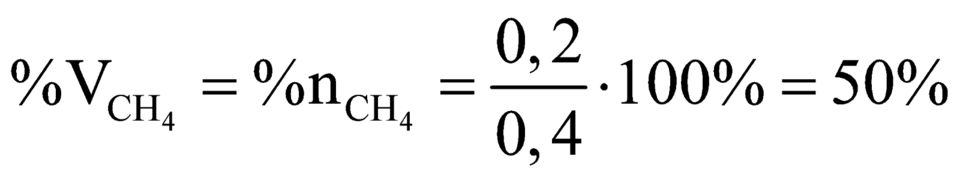

Gọi số mol của C2H4 và C2H2 lần lượt là x và y mol
theo bài ra: x+y = 0,56/22,4 = 0,025 (mol)
Pt:
C2H4 + Br2 → C2H4Br2
x mol x mol x mol
C2H2 + 2 Br2 → C2H2Br4
y mol 2y mol y mol
Số mol n Br2 = x+2y = 5,6/160 = 0,035 9mol)
Giải hệ ta đc: x = 0,015 và y = 0,01
=> %V C2H4 = 0,015/0,025 = 60% ; %V C2H2 = 40%

Bài 3
a) C2H4 + Br2 --> C2H4Br2
C2H2 + 2Br2 --> C2H2Br4
b) \(n_{Br_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\)
Gọi số mol C2H4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{0,56}{22,4}=0,025\) (1)
PTHH: C2H4 + Br2 --> C2H4Br2
a---->a
C2H2 + 2Br2 --> C2H2Br4
b---->2b
=> a + 2b = 0,035 (2)
(1)(2) => a = 0,015 (mol); b = 0,01 (mol)
=> \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,015}{0,025}.100\%=60\%\\\%V_{C_2H_2}=\dfrac{0,01}{0,025}.100\%=40\%\end{matrix}\right.\)
Bài 4:
a)
CH4 + 2O2 --to--> CO2 + 2H2O
2H2 + O2 --to--> 2H2O
b)
Gọi số mol CH4, H2 là a, b (mol)
=> \(a+b=\dfrac{11,2}{22,4}=0,5\) (1)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a-------------------->a--->2a
2H2 + O2 --to--> 2H2O
b--------------->b
=> \(2a+b=\dfrac{16,2}{18}=0,9\) (2)
(1)(2) => a = 0,4 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,4}{0,5}.100\%=80\%\\\%V_{H_2}=\dfrac{0,1}{0,5}.100\%=20\%\end{matrix}\right.\)
c)
VCO2 = 0,4.22,4 = 8,96 (l)
Ta có: \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
_____0,05_____0,1 (mol)
\(\Rightarrow\%V_{C_2H_2}=\dfrac{0,05.22,4}{3,36}.100\%\approx33,33\%\)
\(\%V_{CH_4}\approx66,67\%\)