Dẫn khí CO qua m gam hỗn hợp (A) gồm CuO và Fe2O3 ở nhiệt độ cao. Sau khi phản ứng xảy ra hoàn toàn thu được 6,24 gam hỗn hợp rắn (B) chỉ gồm các kim loại. Cho toàn bộ hỗn hợp (B) tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư thì thu được 2,24 lít khí H2 Viết phương trình hóa học xảy ra và tính thể tích khí CO đã tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
Kim loại màu đỏ không tan là Cu
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
PTHH: CuO + CO --to--> Cu + CO2
0,05<-----------0,05-->0,05
=> mCuO = 0,05.80 = 4 (g)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{4}{20}.100\%=20\%\\\%m_{Fe_2O_3}=100\%-20\%=80\%\end{matrix}\right.\)
b)
\(m_{Fe_2O_3}=\dfrac{20-4}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3CO --to--> 2Fe + 3CO2
0,1----------------------->0,3
=> \(n_{CO_2}=0,05+0,3=0,35\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,35---->0,35
=> \(m_{CaCO_3\left(lý.thuyết\right)}=0,35.100=35\left(g\right)\Rightarrow m_{CaCO_3\left(tt\right)}=\dfrac{35.80}{100}=28\left(g\right)\)

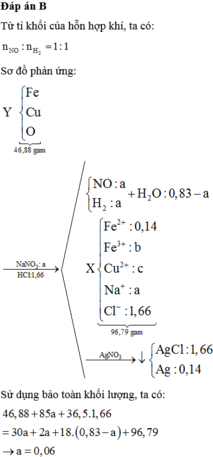
CO tác dụng với hỗn hợp oxit dư thu được khí X là C O 2 .
C O 2 tác dụng với C a O H 2 dư thu được muối duy nhất là kết tủa C a C O 3
⇒ n C O 2 = n N a C O 3 = 4/100 = 0,04 mol
⇒ nCO = n C O 2 = 0,04 mol
⇒ VCO = 0,04.224 = 0,896 lit
⇒ Chọn A.

Đáp án B
Bản chất phản ứng:
CO + Ooxit → CO2
CO2+ Ca(OH)2 → CaCO3↓ + H2O
Theo PTHH: nCO= nCO2= nCaCO3= 4/100 = 0,04mol
→V= 0,896 lít
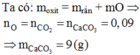



\(CiO+CO\xrightarrow[]{t^0}Cu+CO_2\left(1\right)\\ Fe_2O_3+3CO\xrightarrow[]{t^0}2Fe+3CO_2\left(2\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\\ n_{H_2}=n_{Fe}=0,1mol\\ n_{Cu}=\dfrac{6,24-0,1.56}{64}=0,01mol\\ n_{CO\left(1\right)}=n_{Cu}=0,01mol\\ n_{CO\left(2\right)}=\dfrac{3}{2}n_{Fe}=0,15mol\\ V_{CO}=\left(0,01+0,15\right).22,4=3,584l\)