Cho 10 gam hỗn hợp A gồm 2 kim loại Al và Cu vào dung dịch HCl dư. Khi phản ứng kết thúc thu được 3,36 lít khí không màu (đktc). Tỉ lệ phần trăm Al và Cu trong hỗn A lần lượt là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
Do Al3+/Al > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag ||⇒ Z gồm Fedư, Cu và Ag.
⇒ nFe dư = nH2 = 0,05 mol ||► Trong X có nAl = nFe = 8,3 ÷ (27 + 56) = 0,1 mol.
⇒ dung dịch sau phản ứng chứa 0,05 mol Fe(NO3)2 và 0,1 mol Al(NO3)3.
Đặt nCu(NO3)2 = x; nAgNO3 = y ⇒ ∑nNO3– = 2x + y = 0,05 × 2 + 0,1 × 3.
mrắn không tan = 64x + 108y = 28(g) ||⇒ Giải hệ có: x = 0,1 mol; y = 0,2 mol.
⇒ [Cu(NO3)2] = 1M; [AgNO3] = 2M ⇒ chọn B.

Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:

Đáp án A

Chọn đáp án A
Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:
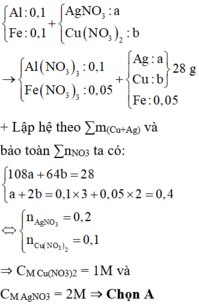

Đáp án A
Vì T chứa 3 kim loại nên T chứa Cu, Ag và Fe dư (Al phản ứng trước Fe).
Khi đó Al, Cu2+ và Ag+ phản ứng hết.
Khi cho T phản ứng với HCl dư, chỉ có Fe phản ứng
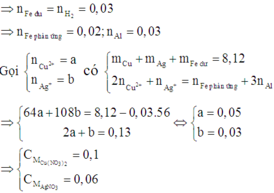

Chọn đáp án A
![]()
⇒ E gồm 3 kim loại thì đó là Ag, Cu và Fe dư ⇒ nFe dư = nH2 = 0,03 mol
Đặt n A g + = x mol; n C u 2 + = y mol ||→ mE = 8,12 gam = 108x + 64y + 0,03 × 56
![]()
![]()
Giải hệ có: x = 0,03 mol; y = 0,05 mol
![]()





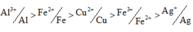
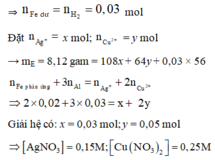
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.1..................................0.15\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Cu}=10-2.7=7.3\left(g\right)\)
\(\%m_{Al}=\dfrac{2.7}{10}\cdot100\%=27\%\)
\(\%m_{Cu}=73\%\)