Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh.
B. Làm quỳ tím hoá đỏ.
C. Phản ứng được với magiê giải phóng khí hydrogen.
D. Không làm đổi màu quỳ tím.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nH+ = 0,05 mol; nOH- = 0,07 mol
H+ + OH- → H2O
Ta thấy H+ hết, OH- dư nên nhúng quỳ tím vào Y thì quỳ tím chuyển thành màu xanh.

\(n_{HCl}=0,2.3=0,6\left(mol\right);n_{Ba\left(OH\right)_2}=0,1.1,5=0,15\left(mol\right)\)
PTHH: Ba(OH)2 + 2HCl ---> BaCl2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,6}{2}>\dfrac{0,15}{1}\Rightarrow\) HCl dư
=> dd sau phản ứng làm QT hóa đỏ

Câu 29: Để tính giá trị của m, ta cần tìm số mol của Ca(OH)2 dùng trong phản ứng. Thể tích dung dịch Ca(OH)2 là 600 ml, nồng độ là 0,5 M, nên số mol của Ca(OH)2 là:
n = V * C = 0,6 * 0,5 = 0,3 mol
Theo phương trình phản ứng:
Ca(OH)2 + CO2 -> CaCO3 + H2O
Ta thấy tỉ lệ tương ứng giữa Ca(OH)2 và CaCO3 là 1:1, nên số mol của kết tủa CaCO3 cũng là 0,3 mol.
Khối lượng của kết tủa CaCO3 có thể tính được bằng công thức:
m = n * MM = 0,3 * 100 = 30 g
Vậy giá trị của m là 30 (đáp án A).
Câu 30: Đáp án D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước.
Câu 31: Đáp án A. NaHCO3.
Câu 32: Đáp án C. BaO tác dụng với dung dịch H2O.
Câu 33: Đáp án A. Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư.
Câu 34: Để tính giá trị của a, ta cần tìm số mol của Na2CO3 dùng trong phản ứng. Theo phương trình phản ứng:
Na2CO3 + 2HCl -> 2NaCl + CO2 + H2O
Ta thấy tỉ lệ tương ứng giữa Na2CO3 và CO2 là 1:1, nên số mol của CO2 cũng là 0,2 mol.
Theo định luật Avogadro, 1 mol khí ở đktc có thể chiếm thể tích là 22,4 lít, nên 0,2 mol CO2 sẽ chiếm thể tích là:
V = n * Vm = 0,2 * 22,4 = 4,48 lít
Tuy nhiên, theo đề bài, thể tích khí CO2 thu được là 3,36 lít, nên số mol của CO2 cần tìm là:
n = V / Vm = 3,36 / 22,4 = 0,15 mol
Theo phương trình phản ứng, tỉ lệ tương ứng giữa Na2CO3 và CO2 là 1:1, nên số mol của Na2CO3 cũng là 0,15 mol.
Khối lượng của Na2CO3 có thể tính được bằng công thức:
m = n * MM = 0,15 * 106 = 15,9 g
Vậy giá trị của a là 15,9 g (đáp án A).
Câu 35: Đáp án D. Ca(H2PO4)2.
Câu 36: Để tính giá trị của m, ta cần tìm số mol của Mg trong hỗn hợp ban đầu. Theo phương trình phản ứng:
Mg + 2HCl -> MgCl2 + H2
Ta thấy tỉ lệ tương ứng giữa Mg và H2 là 1:1, nên số mol của Mg cũng là 1,12 mol.
Khối lượng của Mg có thể tính được bằng công thức:
m = n * MM = 1,12 * 24 = 26,88 g
Sau khi phản ứng với NaOH, Mg(OH)2 tạo thành và kết tủa. Theo phương trình phản ứng:
Mg(OH)2 + 2NaOH -> Mg(OH)2 + 2NaCl + 2H2O
Ta thấy tỉ lệ tương ứng giữa Mg(OH)2 và Mg là 1:1, nên số mol của Mg(OH)2 cũng là 1,12 mol.
Khối lượng của Mg(OH)2 có thể tính được bằng công thức:
m = n * MM = 1,12 * 58 = 64,96 g
Vậy giá trị của m là 64,96 g (đáp án không có trong các lựa chọn).
Câu 37: Đáp án A. AgNO3.
Câu 38: Đáp án D. Giấm.
Câu 39: Đáp án A. H2SO4 đặc nóng.
Câu 40: Đáp án B. Dung dịch HCl.

\(29.\\ n_{CO_2}=\dfrac{8,96}{22,4}=0,4mol\\ n_{Ca\left(OH\right)_2}=0,5.0,6=0,3mol\\ T=\dfrac{0,3}{0,4}=0,75\\ \Rightarrow Tạo.CaCO_3,Ca\left(HCO_3\right)_2\\ n_{CaCO_3}=a;n_{Ca\left(HCO_3\right)_3}=b\\ Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\\ Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\\ \Rightarrow\left\{{}\begin{matrix}a+b=0,3\\a+2b=0,4\end{matrix}\right.\\ \Rightarrow a=0,2;b=0,1\\ m_{kt}=m_{CaCO_3}=0,2.100=20g\\ \Rightarrow B.20\)
\(30.\\ \Rightarrow D\\31.\\ n_{CO_2}=\dfrac{2,24}{22,4}=0,1mol\\ T=\dfrac{0,2}{0,1}=2\\ Tạo.Na_2CO_3\\ 32.\\ \Rightarrow C\\ BaO+H_2O\rightarrow Ba\left(OH\right)_2\\ 33.\\ \Rightarrow A.\\ Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\\ CO+Ca\left(OH\right)_2\xrightarrow[]{}X\\ 34.\\ n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol \\ Na_2CO_3+HCl\rightarrow NaCl+CO_2+H_2O\\ n_{CO_2}=n_{Na_2CO_3}=0,15mol\\ a=m_{Na_2CO_3}=0,15.106=15,9g\\ \Rightarrow A\)

Chọn A
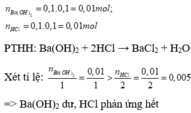
=> Dung dịch sau phản ứng thu được gồm BaC l 2 và Ba(O H ) 2 dư
Vì BaC l 2 là muối, không làm đổi màu quỳ, còn Ba(O H ) 2 là bazơ làm quỳ hóa xanh
=> dung dịch thu được sau phản ứng làm quỳ hóa xanh

- Thí nghiệm 1
Ta có: n HCl = 0,05a ( mol ) ; n Ba(OH)2 = 0,05b ( mol )
n H2SO4 = 0,002 ( mol )
PTHH
Ba(OH)2 + 2HCl ======> BaCL2 + 2H2O
0,025a---0,05a
Ba(OH)2 + H2SO4 =====> BaSO4 + H2O
0,002 -------0,002
theo pthh: 0,025a + 0,002 = 0,05b ( 1 )
- Thí nghiệm 2
Ta có: n HCl = 0,1a ( mol ) ; n Ba(OH)2 = 0,05b ( mol )
n NaOH = 0,002 ( mol )
PTHH
Ba(OH)2 + 2HCL =====> BaCl2 + 2H2O
0,05b------0,1b
NaOH + HCL =====> NaCL + H2O
0,002---0,002
theo pthh : 0,1b + 0,002 = 0,1a ( 2 )
Từ ( 1 ) và ( 2 ) sauy ra a = 0,12 ( mol ) ; b = 0,1 ( mol )
Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh.
B. Làm quỳ tím hoá đỏ.
C. Phản ứng được với magiê giải phóng khí hydrogen.
D. Không làm đổi màu quỳ tím.
Ba(OH)2 + 2HCl → BaCl2 + 2H2O. H2O là chất trung tính, không làm đổi màu quỳ tím.
Thế 2 chất này phản ứng tỉ lệ mol 1:2 mà số mol thực tế đang là 1:1 thì không có chất dư hay sao em?