cho 19,1 hỗn hợp X(Mg,Al,Zn;biết tỉ lệ mol Al:Zn=2:1) phản ứng vừa đủ với 2 lít dd HNO3 xM sau phản ứng thu được hỗn hợp khí gồm 0,1 mol N2 và 0,05 mol N2O và dd Y/
a,% khối lượng của Mg trong X là
b,giá trị của x là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

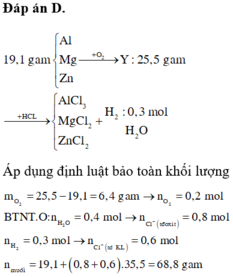
\(19,1gam\) \(:\left\{{}\begin{matrix}Al\\Mg\\Zn\end{matrix}\right.\)\(\underrightarrow{+O_2}\)\(Y:25,5gam\)\(\underrightarrow{+HCl}\left\{{}\begin{matrix}AgCl_3\\MgCl_2\\ZnCl_2\end{matrix}\right.\) + H2 : 0,3 mol
H2O
Áp dụng định luật bảo toàn khối lượng:
\(mO_2=25,5-19,1=6,4gam\) \(\Rightarrow nO_2=0,2\left(mol\right)\)
BTNT O : nH2O = 0,4mol
\(\rightarrow nHCl^-\left(tdOxi\right)=0,8\left(mol\right)\)
\(nH_2=0,3\left(mol\right)\rightarrow nCl^-\left(tdKl\right)=0,6\left(mol\right)\)
\(m_{muối}=19,1+\left(0,8+0,6\right).35,5=68,8\left(g\right)\)

Đáp án D.
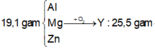
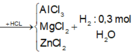
Áp dụng định luật bảo toàn khối lượng
![]()
![]()
![]()
→ n C l - ( t d o x i ) = 0 , 8 m o l
![]()
![]()

2Al + 3H2SO4 →Al2(SO4)3 + 3H2 (1)
Zn + H2SO4 →ZnSO4 + H2 (2)
a;nH2=\(\dfrac{8,96}{22,4}\)=0,4(mol)
Đặt nAl=a
nZn=b
Ta có:
\(\left\{{}\begin{matrix}27x+65y=11,9\\1,5x+y=0,4\end{matrix}\right.\)
=>a=0,2;b=0,1
mAl=27.0,2=5,4(g)
%mAl=\(\dfrac{5,4}{11,9}.100\)=54,4%
%mZn=54,6%
Ta có kim loại + H2SO4 → muối + H2
nH2 = 0,4 mol
Bảo toàn nguyên tố H có nH2 = nH2SO4 = 0,4 mol
Bảo toàn khối lượng có mkim loại + mH2SO4 = mH2 + mmuối → 11,9 + 0,4.98 = 0,4.2 + m → m = 50,3

\(n_{HCl}=0,2.4=0,8\left(mol\right)\)
=> \(n_{H_2O}=0,4\left(mol\right)\)
=> \(n_O=0,4\left(mol\right)\)
mkim loại = moxit - mO = 28,1 - 0,4.16 = 21,7 (g)

1)
mHCl = 25,55.100/100=25,55(g)
=> nHCl = 25,55/36,5=0,7(mol)
Pt: Mg + 2HCl --> MgCl2 + H2
Zn + 2HCl --> ZnCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
+Giả sử trong hh chỉ có Mg
nMg = 5,624=0,235,624=0,23 mol
Pt: Mg +......2HCl
0,23 mol-> 0,46 mol < 0,7 (mol)
=> HCl dư
<=> Hh Mg, Zn, Al bị hòa tan hết

\(n_{HCl} = \dfrac{25,55}{36,5} = 0,7(mol)\\ M_{Mg} = 24 < M_{Al} = 27 < M_{Zn} = 65\\ \Rightarrow n_{\text{hỗn hợp max}} = n_{Mg} = \dfrac{5,6}{24} = \dfrac{7}{30}(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{HCl\ pư} = 2n_{Mg} = \dfrac{7}{15} = 0,467 < 0,7\\ \Rightarrow \text{Kim loại tan hết}\)

a, Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=2y\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27.2y + 65y = 19,1 (1)
BT e, có: 2nMg + 3nAl + 2nZn = 10nN2 + 8nN2O
⇒ 2x + 3.2y + 2y = 10.0,1 + 8.0,05 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,3.24}{19,1}.100\%\approx37,7\%\)
b, Ta có: nHNO3 = 12nN2 + 10nN2O = 1,7 (mol)
\(\Rightarrow C_{M_{HNO_3}}=\dfrac{1,7}{2}=0,85\left(M\right)=x\)