Trộn 50 ml dung dịch CaCl2 0,2 M với 100 ml dung dịch AgNO3 chưa rõ nồng độ sau khi phản ứng vừa đủ thì được chất rắn X vào dung dịch Y . Tính nồng độ mol của chất có trong dung dịch Y .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1. \(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl_{\downarrow}\)
\(n_{AgCl}=\dfrac{28,7}{143,5}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgCl}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,1}{0,15+0,05}=0,5\left(M\right)\)
2. \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
BTNT Na, có: nNaOH = nNa = 0,1 (mol)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Xét tỉ lệ \(\dfrac{0,2}{2}>\dfrac{0,1}{2}\), ta được Al dư.
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{NaOH}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
\(n_{Al\left(pư\right)}=n_{NaOH}=0,1\left(mol\right)\Rightarrow n_{Al\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Al\left(dư\right)}=0,1.27=2,7\left(g\right)\)

\(n_{BaCl_2}=0,1.1=0,1\left(mol\right)\\ BaCl_2+K_2CO_3\rightarrow BaCO_3\downarrow+2KCl\\ Chất.tan.dd.sau.p.ứ:KCl\\ n_{KCl}=2.0,1=0,2\left(mol\right)\\ V_{ddsau}=V_{ddBaCl_2}+V_{ddK_2CO_3}=100+100=200\left(ml\right)=0,2\left(l\right)\\ \Rightarrow C_{MddKCl}=\dfrac{0,2}{0,2}=1\left(M\right)\)

MgCl2+2AgNO3->Mg(NO3)2+2AgCl
0,04-----0,08-----------0,04----------0,08
n MgCl2=0,1 mol
n AgNO3=0,08 mol
=>Mgcl2 dư
=>m AgCl=0,08.143,5=11,48g
=>CMMg(NO)2=\(\dfrac{0,04}{0,2}\)=0,2M
=>CMMgcl2 dư=\(\dfrac{0,06}{0,2}\)=0,3M
\(n_{MgCl_2}=0,1\cdot1=0,1mol\)
\(n_{AgNO_3}=0,1\cdot0,8=0,08mol\)
\(MgCl_2+2AgNO_3\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\)
0,1 0,08 0 0
0,04 0,08 0,08 0,04
0,06 0 0,08 0,04
\(m_{\downarrow}=0,08\cdot143,5=11,48g\)
\(C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{n_{Mg\left(NO_3\right)_2}}{V_X}=\dfrac{0,04}{0,2}=0,2M\)

Chất rắn Y chứa 3 kim loại là Ag, Cu, Fe dư.
Y + HCl → 0,035 mol H2 nên n(Fe trong Y) = 0,035 mol
→ n(Fe phản ứng) = 0,05 – 0,035 = 0,015 mol
Đặt n(AgNO3) = x ; n(Cu(NO3)2) = x
Áp dụng ĐLBT mol e : n(AgNO3) + 2n(Cu(NO3)2) = n(Al) + n(Fe phản ứng)
→ x = 0,04 mol
→ CM(AgNO3) = CM(Cu(NO3)2) = 0,4M → Đáp án B
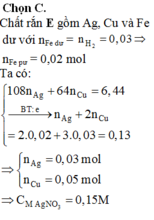
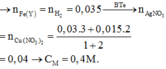
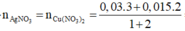
Ta có: \(n_{CaCl_2}=0,05.0,2=0,01\left(mol\right)\)
PT: \(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
Theo PT: \(n_{Ca\left(NO_3\right)_2}=n_{CaCl_2}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,01}{0,05+0,1}=\dfrac{1}{15}\left(M\right)\)