Hỗn hợp A gồm bột nhôm và sắt được chia thành 2 phần bằng nhau :Hòa tan hoàn toàn 1 phần bằng đ H2SO4 loãng dư thu được dd B . Thêm dd NaOH dư vào dung dịch B , lấy toàn bộ kết tủa nung trong không khí ở nhiệt độ cao tới khi khối lượng không đổi thì thu được 8 gam chất rắn . Cho phần 2 tác dụng với dd NaOH dư thấy thể tích khí thoát ra là 3,36 lít ( đktc ).Tìm phần trăm khối lượng của hỗn hợp A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

$n_{NaOH} = 0,2.2,5 = 0,5(mol)$
$BaCl_2 + Na_2CO_3 \to BaCO_3 + 2NaCl$
$n_{Na_2CO_3} = n_{BaCO_3} = \dfrac{39,4}{197} = 0,2(mol)$
TH1 : có tạo muối axit
$CO_2 + 2NaOH \to Na_2CO_3 + H_2O$
$CO_2 + NaOH \to NaHCO_3$
Suy ra:
$n_{NaHCO_3} = n_{NaOH}- 2n_{Na_2CO_3} = 0,5 - 0,2.2 = 0,1(mol)$
$n_{CO_2} = n_{Na_2CO_3} + n_{NaHCO_3} = 0,3(mol)$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$RCO_3 + 2HCl \to RCl_2 + CO_2 + H_2O$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,3}{2} = 0,15(mol)$
Suy ra:
$0,15.84 + 0,15.(R + 60) = 20 \Rightarrow R = -10,6 \to$ Loại
TH2 : NaOH dư
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$n_{CO_2} = n_{Na_2CO_3} = 0,2(mol)$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,2}{2} = 0,1(mol)$
$\Rightarrow 0,1.84 + 0,1(R + 60) = 20 \Rightarrow R = 56(Fe)$
$\%m_{MgCO_3} = \dfrac{0,1.84}{20}.100\% = 42\%$
$\%m_{RCO_3} = 100\% -42\% = 58\%$

Đáp án C
Phần 1: Tác dụng vói dung dịch H2SO4 loãng gồm Al và FexOy nên n H 2 = 3 2 n Al ⇒ n Al = 0 , 02
Phần 2: Thực hiện phản ứng nhiệt nhôm hoàn toàn và hỗn hợp B tác dụng với dung dịch NaOH dư có H2 nên B có Fe, A12O3 và Al dư. Có n Al du = 2 3 n H 2 ( NaOH ) = 0 , 004 .
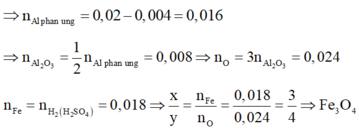

\(\text{a) Khối lượng phần 1 = Khối lượng phần 2 = 78.4/2=39.2}\)
Đặt công thức của oxit sắt là \(Fe_xO_y\)
Phần 1: \(CuO+CO\underrightarrow{t^0}Cu+CO_2\)
\(Fe_xO_y+yCO\underrightarrow{t^0}xFe+yCO_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\Rightarrow m_{Cu}=12.8\Rightarrow n_{Cu}=n_{CuO}=0.2\Rightarrow m_{CuO\left(\text{1 phần}\right)}=0.2\times80=16\left(g\right)\)
\(\Rightarrow\%^mCuO=\dfrac{16}{39.2}\times100\approx40.81\%\Rightarrow\%^mFe_xO_y=51.9\%\)
b)
\(\text{Đặt số mol của Fe_xO_y là a( mol)}\)
\(CuO+2HCl\rightarrow CuCl_2+H_2\)
0.2 0.4
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\dfrac{2y}{x}}+yH_2O\)
a 2ay
\(\Sigma^nHCl=\dfrac{43.8}{36.5}=1.2\left(mol\right)\)
=> 2ay+0.4=1.2=>ay=0.4 (1)
\(m_{Fe_xO_y\left(\text{1 phần}\right)}=39.2-16=23.2\Rightarrow n_{Fe_xO_y}=a=\dfrac{23.2}{56x+16y}\left(mol\right)\)
=>(56x+16y)a=23.2=>56ax+16ay=23.2 (2)
Từ (1) (2) => 56ax+16*0.4=23.2=>56ax=16.8=> ax=0.3 (3)
\(\text{Từ (1) (3)}\Rightarrow\dfrac{ax}{ay}=\dfrac{0.3}{0.4}\Rightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Công thức oxit sắt là \(Fe_3O_4\)
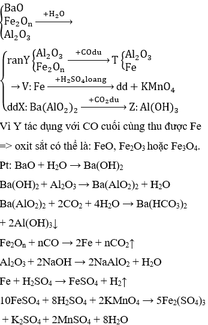
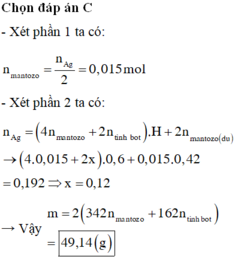
- Phần 1:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_{2\downarrow}+Na_2SO_4\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{FeSO_4}=n_{Fe\left(OH\right)_2}=2n_{Fe_2O_3}=0,1\left(mol\right)\)\
- Phần 2:
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\)
%m trong 1 phần cũng là %m trong A.
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{0,1.56+0,1.27}.100\%\approx67,47\%\\\%m_{Al}\approx32,53\%\end{matrix}\right.\)