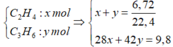Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của etilen và propilen lần lượt là x và y mol.
Khối lượng dung dịch sau phản ứng tăng lên chính là khối lượng của hỗn hợp etilen và propilen.
Ta có hệ phương trình:
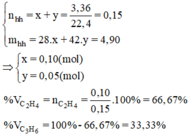

a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)

Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Mà: m dd tăng sau pư = mC2H4 + mC2H2
⇒ 4,9 = 28nC2H4 + 26nC2H2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{C_2H_4}=-0,15\\n_{C_2H_2}=0,35\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.

B5:
1)
\(V_{thoát}=V_{CH_4\left(đktc\right)}=3,36\left(l\right)\\ \Rightarrow\%V_{\dfrac{CH_4}{B}}=\dfrac{3,36}{4,48}.100=75\%\Rightarrow\%V_{\dfrac{C_2H_4}{B}}=100\%-75\%=25\%\)
2)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\\ n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{CaCO_3}=n_{CO_2}=n_{CH_4}=0,15\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{CaCO_3}=100.0,15=15\left(g\right)\)

\(n_{C_2H_4} = a\ mol;n_{C_3H_6} = b\ mol\\ \Rightarrow a + b = \dfrac{3,36}{22,4} = 0,15(1)\\ C_2H_4 + Br_2 \to C_2H_4Br_2\\ C_3H_6 + Br_2 \to C_3H_6Br_2\\ m_{tăng} = 28a + 42b = 4,9(2)\\ (1)(2)\Rightarrow a = 0,1; b = 0,05\\ \%V_{C_2H_4} = \dfrac{0,1}{0,15}.100\% = 66,67\%\\ \%V_{C_3H_6} = 100\% -66,67\% = 33,33\%\)