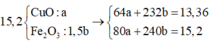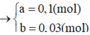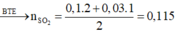Cho 2,236 gam hỗn hợp A dạng bột gôm Fe và Fe3O4 hòa tan trong H2SO4 đặc nóng, thu được dung dịch X và có 269,6 ml khí SO2 duy nhất (đktc) thoát ra. Sau phản ứng còn lại 0,448 gam kim loại. a.Tính khối lượng muối trong dung dịch X b.Tính khối lượng H2SO4 98% đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sau phản ứng còn kim loại => Sản phẩm là Fe2+
=>Giả sử có x mol Fe và y mol O phản ứng
=> 56x + 16y = 2,236 – 0,448 = 1,788g
Các quá trình: +/ Cho e: Fe → Fe+2 + 2e
+/ Nhận e : O + 2e → O-2
N+5 +3e → N+2
=> n e trao đổi = 2x = 2y + 0,011.3
=>x= 0,0285 mol ; y= 0,012 mol
=> số mol HNO3 = 2nFe2+ + n NO = 0,068 mol (Bảo toàn N)
=> C = 0,68M
=>B

Đáp án A
Quy hỗn hợp X về dạng Fe và O.
=> mX = 56nFe + 16nO = 14,4g (1)
- Khi X + H2SO4: Bảo toàn e: 3nFe = 2nO + 2nSO2
=> 3nFe – 2nO = 2.6,72: 22,4 = 0,6 mol (2)
Từ (1,2) => nFe = 0,24; nO = 0,06 mol
Vậy muối trong dung dịch sau phản ứng sẽ là: 0,12 mol Fe2(SO4)3
=> mFe2(SO4)3 = 0,12.400 = 48g

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
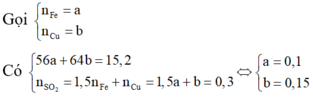
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

Gọi x,y lần lượt là số mol Mg, Fe
Mg + S ⟶ MgS
Fe + S ⟶ FeS
MgS + 4H2SO4 → MgSO4 + 4H2O + 4SO2
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
S + 2H2SO4 → 3SO2 + 2H2O
Ta có :
\(\left\{{}\begin{matrix}Mg:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\underrightarrow{+S:0,5\left(mol\right)}\left\{{}\begin{matrix}MgS:x\left(mol\right)\\FeS:y\left(mol\right)\\S_{dư}:0,5-\left(x+y\right)\left(mol\right)\end{matrix}\right.\underrightarrow{+H_2SO_4}\left\{{}\begin{matrix}MgSO_4:x\left(mol\right)\\Fe_2\left(SO_4\right)_3:\dfrac{y}{2}\left(mol\right)\\SO_2\end{matrix}\right.\underrightarrow{+NaOH\left(dư\right)}\left(kt\right)\left\{{}\begin{matrix}Mg\left(OH\right)_2:x\left(mol\right)\\Fe\left(OH\right)_3:y\left(mol\right)\end{matrix}\right.\underrightarrow{to}\left\{{}\begin{matrix}MgO:x\left(mol\right)\\Fe_2O_3:\dfrac{y}{2}\left(mol\right)\end{matrix}\right.\)
Ta có :\(n_{SO_2}=4x+4,5y+\left[0,5-\left(x+y\right)\right].3=2\left(mol\right)\)
\(40x+160\dfrac{y}{2}=24\)
=> \(\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(m=4,8+11,2=16\left(g\right)\)
\(\%m_{Mg}=\dfrac{4,8}{16}.100=30\%\)
\(\%m_{Fe}=100-30=70\%\)

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
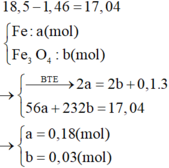
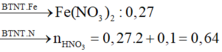
=> [HNO3] = 3,2 (M)