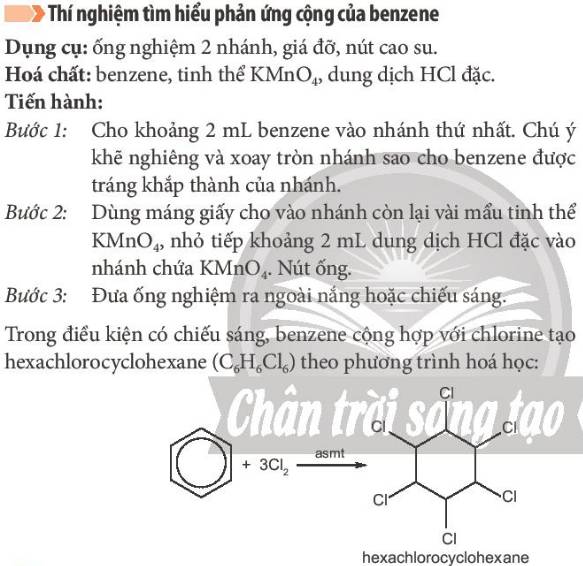
5. Quan sát, ghi nhận hiện tượng xảy ra trong thí nghiệm cộng chlorine vào benzene. Giải thích.
6. Em hãy cho biết vai trò của các hoá chất KMnO4 và HCl dùng trong thí nghiệm.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hiện tượng: Thấy có lớp chất lỏng nặng màu vàng nhạt, sánh như dầu lắng xuống.

P đỏ được đặt trên thanh sắt gần ngọn lửa hơn P trắng (to cao hơn). Hiện tượng: P trắng bốc cháy còn P đỏ thì không. Chứng tỏ P trắng dễ phản ứng với oxi hơn P đỏ rất nhiều. Thực tế P trắng có thể bị oxi hoá trong không khí ở nhiệt độ thường (hiện tượng phát quang hoá học), còn P đỏ thì bốc cháy khi đun nóng ở nhiệt độ 250oC.
4P +5O2 → 2P2O5

1/ Thí nghiệm 1: Điều chế clo. Tính tẩy màu của khí clo ẩm
6HCl + KClO3 --> KCl + 3Cl2 + 3H2O
Cl2 sinh ra sẽ tác dụng với nước làm cho dd tạo thành chứ HClO --> HCl + [O], chính [O] này sẽ làm mất màu tời giấy màu ban đầu
2/ Thí nghiệm 2: So sánh tính oxi hoá của clo, brom và iot
-- Dùng Clo, ở muối NaBr sẽ xuất hiện màu nâu đỏ của brôm mới tạo thành Cl2 + 2 NaBr --> 2NaCl + Br2. Ổ NaI sẽ có màu vàng nhạt xuất hiện của iod mới tạo thành, Cl2 + 2NaI --> 2NaCl + I2
- Dùng brôm chỉ thấy màu vàng của iod sinh ra Br2 + 2NaI --> 2NaBr + I2
- Dùng iod hok có hiện tượng
---> nhận xét tính oxi hoá giảm gần theo thứ tự Cl2 > Br2 > I2
3/ Thí nghiệm 3: Tác dụng của iot với hồ tinh bột
Cho vào ống nghiệm một ít hồ tinh bột. Nhỏ 1 giọt nước iot vào ống nghiệm. Quan sát hiện tượng và nêu nguyên nhân.
Hồ tinh bột sẽ hoá xanh do iod có tính khử, tạo phức được với tinh bột
4/ Thí nghiệm 4: Tính axit của HCl
- Lấy 4 ống nghiệm sạch. Bỏ vào 1 trong các ống 1 trong các chất rắn sau đây
+ 1 ít Cu(OH)2 màu xanh (Điều chế bằng cách nhỏ dung dịch NaOH vào dung dịch CuSO4 rồi gạn lấy kết tủa)
2NaOH + CuSO4 --> Cu(OH)2 + NaSO4
Cu(OH)2 + 2HCl --> CuCl2 + 2 H2O --> tủa sẽ tan dần
+ 1 ít bột CuO màu đen
CuO + 2HCl --> CuCl2 + H2O, chất rắn màu đen tan dần, tạo thành dd trong suốt
+ 1 ít bột CaCO3 màu trắng (hoặc một mẩu đá vôi)
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O --> đá vôi tan dần, có khí thoát ra
+ 1 viên kẽm
Zn + 2HCl --> ZnCL2 + H2 --> viên kẽm tan và cho khí bay ra
5. Thí nghiệm 5: Tính tẩy màu của nước Gia-ven
Cho vào ống nghiệm khoảng 1 ml nước Gia-ven. Bỏ tiếp vào ống 1 vài miếng vải hoặc giấy màu. Để yên 1 thời gian. Quan sát hiện tượng. Nêu nguyên nhân
vải hoặc giấy màu sẽ mất màu dần do trong nước janven chứa NaClO. CHính chất này sẽ tạo thành NaCl + [O], với sự có mặt của [O] làm cho dd có tình tẩy rửa.
6. Thí nghiệm 6: Bài tập thực nghiệm phân biệt các dung dịch
Mỗi bình có chứa 1 trong các dung dịch NaBr, HCl, NaI, và NaCl (không ghi nhãn)
- Dùng quỳ tím, nhận ra HCl vì quỳ tím đổi sang màu đỏ, còn 3 muối NaCl, NaI, NaBr đều hok làm quỳ tìm đổi màu
- Dùng tiếp dd nước brôm, chất nào làm dd brom mất màu nâu đỏ và xuất hiện màu vàng là NaI. 2NaI + Br2 --> 2NaBr + I2
- Dùng tiếp dd nước Cl2, chất nào xuât hiện màu nâu đỏ là NaBr. 2NaBr + Cl2 --> 2NaCl + Br2
còn lại là NaCl

Hoá chất cần chọn: CuO, HCl, Zn
- Cho Zn tác dụng với HCl: Zn tan dần trong HCl sinh ra chất khí ko màu, mùi, và đưa ngọn lửa đèn cồn lại gần thì thấy cháy có màu xanh nhạt, có tiếng nổ nhỏ
Zn + 2HCl ---> ZnCl2 + H2
- Dẫn H2 qua CuO nung nóng: chất rắn màu đen CuO chuyển dần sang màu đỏ là Cu và xung quanh thành ống thí nghiệm có bám nước, điều đó CM H2 có tính khử oxi trong các h/c oxit kim loại
CuO + H2 --to--> Cu + H2O

mk trả lời đc mỗi câu 2 thôi nha :
- Cao su sống là nhựa của cây cao su , mới được khai thác và chưa qua chế biến
- Cao su sống sau khi qua 1 quá trình chế biến hóa - lý sẽ thành cao su tổng hợp có độ bền cao
- Cao su tổng hợp là vật liệu để chế tạo các loại lốp xe ( ô tô, xe máy ,xe đạp,..) và nhiều vật dụng / thiết bị khác
k mk nha
Câu 1: Ghế làm từ ghỗ hoặc nhựa; lịch làm từ giấy, v.v
Câu 2: Vì cao su dẻo, có tính đàng hồi tốt không như lúc phát minh ra xe đạp, khi đó lốp xe còn làm từ gỗ (cái này mình nói thêm)
Câu 3: Khi nhỏ mực vào cốc nước, giọt mực từ từ hòa tan vào nước.
Câu 4: Cát lẫn nước thì chúng ta lọc bằng khăn vì nước là dạng chất lỏng, còn cát thì là những hạt cát to, không thể thấm vào khăn được.
Mình biết có bao nhiêu đó thôi. Mình cũng học lớp sáu nè, học tốt nhé!

Thí nghiệm 1
- Hiện tượng
Miếng Na tan dần.
Có khí thoát ra.
Miếng giấy lọc có tẩm phenolphtalein đổi thành màu đỏ.
- Phương trình hóa học: 2Na + H2O → 2NaOH + H2.
- Giải thích: Do Na phản ứng rất mạnh với nước tạo dung dịch bazo làm phenol chuyển hồng, phản ứng giải phóng khí H2.
Thí nghiệm 2
- Hiện tượng: Mẩu vôi nhão ra và tan dần
Phản ứng tỏa nhiều nhiệt.
Dung dịch đổi quỳ tím thành màu xanh (nếu dùng phenolphtalein thì đổi thành màu đỏ)
- Phương trình hóa học: CaO + H2O → Ca(OH)2.
- Giải thích: CaO tan trong nước tạo dung dịch Ca(OH)2 có tính bazo làm quỳ tím chuyển xanh (phenolphtalein chuyển hồng), phản ứng tỏa nhiệt.
Thí nghiệm 3
- Hiện tượng: Photpho cháy sáng.
Có khói màu trắng tạo thành.
Sau khi lắc khói màu trắng tan hết.
Dung dịch làm quỳ tím chuyển thành màu đỏ.
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4.
- Giải thích:
Photpho đỏ phản ứng mạnh với khí Oxi tạo khói trắng là P2O5. P2O5 là oxit axit, tan trong nước tạo dung dịch axit H3PO4 là quỳ tím chuyển đỏ.

Hình 20.1: giọt nước màu dịch chuyển sang bên phải. Vì khi áp chặt tay vào bình cầu, tay ta truyền nhiệt cho bình, không khí trong bình cầu nóng lên nở ra đẩy giọt nước màu dịch chuyển.
Hình 20.2: do không khí nở ra nên có một lượng không khí thoát ra ở đầu ống thủy tinh, tạo ra những bọt không khí nổi lên mặt nước.

a, Có sủi bọt khí (CO2)
PTHH: H2SO4 + Na2CO3 -> Na2SO4 + CO2 + H2O
Do H2SO4 loãng có tác dụng với Na2CO3, sau phản ứng đáng ra tạo axit cacbonic nhưng vì axit này yếu phân li thành CO2 và H2O
b, Có kết tủa trắng (AgCl)
b, Có kết tủa trắng
PTHH: HCl + AgNO3 ->AgCl (kt trắng) + HNO3
Giải thích HCl tác dụng với AgNO3 tạo muối AgCl không tan (kt trắng) và HNO3
Bài 6:
KMnO4 và HCl trong thí nghiệm được dùng để điều chế chlorine
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
Bài 5:
Hiện tượng: xuất hiện khói trắng, trên thành thấy xuất hiện một lớp bột màu trắng (Hexachlorocyclohexane).
C6H6 + 3 Cl2 -> (as) C6H6Cl6