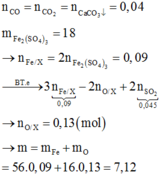cho 20g hỗn hợp X chứa Mg và kim loại R vào dung dịch Hcl dư. sau khi phản ứng kết thúc thu được11,2l khí H2(đktc). mặt khác, cho 20g hỗn hợp X trên tan hoàn toàn trong dung dịch H2SO4 đặc,nóng dư thu được dung dịch Y và 14l khí SO2(đktc) duy nhất. tìm kim loại R và tính thành phần % về khối lượng từng chất có trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

-Đặt số mol của Mg và kim loại M lần lượt là : x và y
Các phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
x................................................x
2M + 2nHCl → 2MCln + nH2 (có thể có)
y...................................................\(\dfrac{ny}{2}\)
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
x....................................................x
2M + 2mH2SO4 → M2(SO4)m + mSO2 + 2mH2O
y ..........................................................\(\dfrac{my}{2}\) ![]()
Số mol của H2 là : \(\dfrac{8,96}{22,4}\) = 0,4 mol
Số mol của SO2 là : \(\dfrac{11,2}{22,4}\) = 0,5 mol
Trường hợp 1. Kim loại M không phản ứng với dung dịch HCl.
Theo bài ra và các phương trình trên ta có :
24x + My = 16 (1)
x = 0,4 (2)
x + \(\dfrac{my}{2}\)= 0,5 (3)
Từ (1), (2), (3) ta có : M = 32m
-Nếu m = 1 → M = 32 (loại)
-Nếu m = 2 → M = 64 (Cu)
-Nếu m = 3 → M = 96 (loại)
\(\rightarrow\)Vậy kim loại M là Cu
- Trường hợp 2. Kim loại M phản ứng với dung dịch HCl.
Theo bài ra và các phương trình trên ta có :
24x + My = 16 (4)
x +\(\dfrac{ny}{2}\) = 0,4 (5)
x + \(\dfrac{my}{2}\)= 0,5 (6)
Theo (5) và (6) thấy m > n
|
n |
1 | 1 | 2 |
|
m |
2 |
3 |
3 |
|
x |
0,3 |
0,35 |
0,2 |
|
y |
0,2 |
0,1 |
0,2 |
|
M |
44 (loại) |
76 (loại) |
56 (Fe) |
Vậy kim loại M là Fe

Đáp án A
Nhận thấy, nFe2+(dd Y) = nNO2 – 2nH2 = 0,39 – 2.0,04 = 0,31 mol
Giả sử nHCl = 2a; nH2SO4 = a
nBaSO4 = a, nAgCl = 4a, nAg = nFe2+ = 0,31 => 233a + 143,5.4a + 0,31.108 = 211,02 => a = 0,22
BTNT H => nHCl + 2nH2SO4 = 2nH2 + 2nH2O => nH2O = (0,44 + 2.0,22 – 2.0,04)/2 = 0,4 mol
BTKL: m = mX + mHCl + mH2SO4 – mH2 – mH2O = 29,68 + 0,44.36,5 + 0,22.98 – 0,04.2 – 0,4.18 = 60,02 gam

Đáp án A
Nhận thấy, nFe2+(dd Y) = nNO2 – 2nH2 = 0,39 – 2.0,04 = 0,31 mol
Giả sử nHCl = 2a; nH2SO4 = a
nBaSO4 = a, nAgCl = 4a, nAg = nFe2+ = 0,31 => 233a + 143,5.4a + 0,31.108 = 211,02 => a = 0,22
BTNT H => nHCl + 2nH2SO4 = 2nH2 + 2nH2O => nH2O = (0,44 + 2.0,22 – 2.0,04)/2 = 0,4 mol
BTKL: m = mX + mHCl + mH2SO4 – mH2 – mH2O = 29,68 + 0,44.36,5 + 0,22.98 – 0,04.2 – 0,4.18 = 60,02 gam

Đáp án A
Quy hỗn hợp X chứa hai chất: FeO xmol và Fe2O3 y mol
Cho X+ khí CO→Chất rắn Y + khí Z chứa CO, CO2
CO2+ Ca(OH)2 → CaCO3+ H2O
Có: nCO2= nCaCO3= 0,04 mol
Cho Y + H2SO4 đặc nóng dư thu được nSO2=0,045 mol
- Quá trình cho e:
FeO → Fe3++ 1e
x x mol
C+2 → C+4+ 2e
0,04 0,08 mol
- Quá trình nhận electron:
S+6+ 2e → SO2
0,09← 0,045 mol
Theo định luật bảo toàn electron:
ne cho= ne nhận → x+0,08 = 0,09→ x= 0,01mol
Muối thu được sau phản ứng là Fe2(SO4)3
→ nFe2(SO4)3= 18/400= 0,045 mol
Bảo toàn nguyên tố Fe ta có:
x+ 2y= 0,045.2→ y= 0,04 mol
→ m= mFeO + mFe2O3=72x + 160y= 72.0,01+ 160.0,04= 7,12 gam

- Cho 4,95 (g) R pư với HCl, thấy kim loại dư.
Ta có: \(n_{HCl}=\dfrac{5,475}{36,5}=0,15\left(mol\right)\)
PT: \(R+2HCl\rightarrow RCl_2+H_2\)
\(n_{R\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,075\left(mol\right)\)
\(n_{R\left(banđau\right)}>0,075\Rightarrow\dfrac{4,95}{M_R}>0,075\Rightarrow M_R< 66\left(g/mol\right)\) (1)
- Cho 18,6 (g) hh Fe và R pư với H2SO4 dư.
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{hh}=n_{Fe}+n_R=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow\overline{M_{hh}}=\dfrac{18,6}{0,3}=62\left(g/mol\right)\)
Mà: MFe < 62 (g/mol) → MR > 62 (g/mol) (2)
Từ (1) và (2) ⇒ 62 < MR < 66
→ R là Zn (65 g/mol)