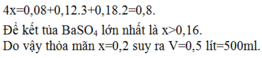Hòa tan hết 22,2 gam hỗn hợp Al và Fe trong dung dịch H2SO4 vừa đủ, sau phản ứng thu được dung dịch X và 13,44 lít H2(đktc). Cho dung dịch NaOH từ từ vào dung dịch X để thu được kết tủa lớn nhất. Nung kết tủa đó đến khối lượng không đổi được chất rắn Y. 1.Viết các PTPU xảy ra? 2.Tính khối lượng chất rắn Y?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
![]()
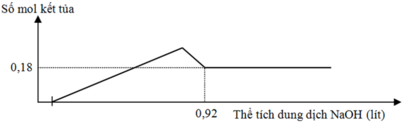
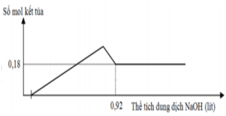
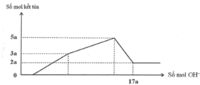
Đồ thị trải qua các giai đoạn:
+Chưa xuất hiện kết tủa do NaOH trung hòa axit dư.
+Kết tủa tăng dần.
+Kết tủa giảm dần do NaOH hòa tan Al(OH)3, kết tủa sau cùng chỉ còn lại là Mg(OH)2.
Nhận thấy lúc 0,92 mol NaOH phản ứng thì kết tủa thu được là 0,18 mol Mg(OH)2
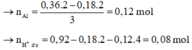
Giải được số mol H2SO4 0,16 mol, HCl 0,48 mol.
Cho V ml Ba(OH)2 0,4M và NaOH 0,8M chứa x mol Ba(OH)2 và 2x mol NaOH.
Để kết tủa hidroxit lớn nhất là 4x=0,08+0,12.3+0,18.2=0,8.
Để kết tủa BaSO4 lớn nhất là x>0,16.
Do vậy thỏa mãn x=0,2 suy ra V=0,5 lít=500ml.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
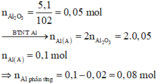
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
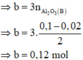
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
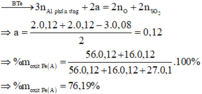

Chọn đáp án C
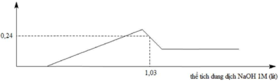
Đặt nMg = x; nAl = y ⇒ 24x + 27y = 7,98g; nH2 = x + 1,5y = 0,4 mol. Giải hệ có: x = 0,13 mol; y = 0,18 mol.
Tại 1,3 mol NaOH thì kết tủa gồm 0,13 mol Mg(OH)2 và (0,24 - 0,13 = 0,11) mol Al(OH)3.
⇒ dung dịch gồm (0,18 - 0,11 = 0,07) mol NaAlO2 và (1,03 - 0,07) ÷ 2 = 0,48 mol Na2SO4
⇒ a = nNa2SO4 = 0,48 mol ⇒ chọn C.