Cho 20,16 l khí CO (đktc) qua hỗn hợp chứa một lượng oxit của kim loại M (chưa rõ hóa trị), nung nóng. Sau khi pứ xảy ra hoàn toàn, thu được 25,2 gam kim loại M và hỗn hợp khí X có tỉ khối so với H2 = 58/3. Cho toàn bộ X qua bình chứa dung dịch nước vôi trong dư, tạo ra m gam muối CaCO3 kết tủa. Hòa tan hoàn toàn lượng kim loại M bằng dung dịch HCl dư thu được 10,08 l H2 (đktc).
a. Xác định CTHH của oxit
b. Tính giá trị của m
Giúp em với:(

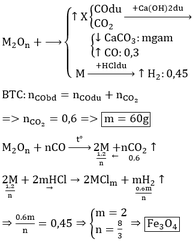


a, - Hh khí X gồm: CO2 và CO dư.
BTNT C, có: \(n_{CO_2}+n_{CO\left(dư\right)}=\dfrac{20,16}{22,4}=0,9\left(mol\right)\left(1\right)\)
Mà: dX/H2 = 58/3 \(\Rightarrow\dfrac{44n_{CO_2}+28n_{CO\left(dư\right)}}{n_{CO_2}+n_{CO\left(dư\right)}}=\dfrac{58}{3}.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=0,6\left(mol\right)\\n_{CO\left(dư\right)}=0,3\left(mol\right)\end{matrix}\right.\)
Bản chất pư: \(CO+O\rightarrow CO_2\)
⇒ nO (trong oxit) = nCO2 = 0,6 (mol)
- \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Giả sử M có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,9}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{25,2}{\dfrac{0,9}{n}}=28n\left(g/mol\right)\)
Với n = 2 thì MM = 56 (g/mol)
→ M là Fe. ⇒ nM = 0,45 (mol)
Gọi CTHH của oxit là FexOy
⇒ x:y = 0,45:0,6 = 3:4
Vậy: CTHH cần tìm là Fe3O4.
b, BTNT C, có: nCaCO3 = nCO2 = 0,6 (mol)
⇒ mCaCO3 = 0,6.100 = 60 (g)