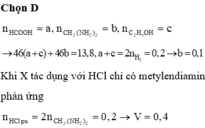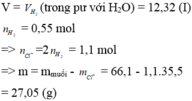Cho 14 gam hỗn hợp X gồm K, Na, K2O, Na2O tác dụng với V lít dung dịch HCl 2M ( vừa đủ ) thu được 2,24 lít khí H2 (đktc), dung dịch thu được chỉ chứa các muối NaCl và 14,9g KCl. Giá trị của V là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Các phản ứng tạo kết tủa:
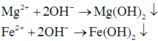
Dung dich X có ![]()
Dung dịch Y có ![]()
Mà ![]() nên OH-dư và
nên OH-dư và ![]()
Vậy ![]()

\(n_{H_2}=\dfrac{2.464}{22.4}=0.11\left(mol\right)\)
\(n_{NaCl}=\dfrac{22.23}{58.5}=0.38\left(mol\right)\)
Quy đổi hỗn hợp thành : Na , K và O.
\(n_{Na}=n_{NaCl}=0.38\left(mol\right)\)
Bảo toàn e :
\(n_{Na}+n_K=2n_O+2n_{H_2}\)
\(\Rightarrow n_K-2n_O=-0.16\left(1\right)\)
Bảo toàn khối lượng :
\(23\cdot0.38+39n_K+16n_O=30.7\left(g\right)\)
\(\Rightarrow39n_K+16n_O=21.96\left(2\right)\)
\(\left(1\right),\left(2\right):n_K=0.44,n_O=0.3\)
\(m_{KCl}=0.44\cdot74.5=32.78\left(g\right)\)

Đáp án C
Vì khối lượng hỗn hợp kim loại ở hai phần bằng nhau và hóa trị của các kim loại trong hỗn hợp là duy nhất nên tổng số mol electron trao đổi ở hai phần là như nhau.
Áp dụng định luật bảo toàn mol electron ta có:
![]()

Đáp án B
nOH- = 2nH2 = 0,4
nCl- = 2nH2 = 0,3
m↓ = 5,2 + 0,3.17 = 10,3 g
mmuối = 5,2+0,3.35,5= 15,85 g

Đặt x,y, z lần lượt là số mol của Na,Al,Mg trong m gam hỗn hợp A
m gam A + H2O dư
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
x--------------------x--------->0,5x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x<------x-------------------------------------->1,5x
=> \(0,5x+1,5x=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) (1)
2m gam A + NaOH
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
2x------------------------------->x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2y---------------------------------------------->3y
=> \(x+3y=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) (2)
3m gam A + HCl
\(Na+HCl\rightarrow NaCl+\dfrac{1}{2}H_2\)
3x--------------------------->1,5x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
3y----------------------------->4,5y
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
3z----------------------------->3z
=> \(1,5x+4,5y+3z=\dfrac{22,4}{22,4}=1\left(mol\right)\) (3)
Từ (1), (2), (3) =>\(\left\{{}\begin{matrix}x=0,05\\y=\dfrac{7}{60}\\z=\dfrac{2}{15}\end{matrix}\right.\)
=> \(m_{Na}=0,05.23=1,15\left(g\right)\)
\(m_{Al}=\dfrac{7}{60}.27=3,15\left(g\right)\)
\(m_{Mg}=\dfrac{2}{15}.24=3,2\left(g\right)\)
=> \(m=1,15+3,15+3,2=7,5\left(g\right)\)
=> \(\%m_{Na}=\dfrac{1,15}{7,5}.100=15,33\%\)
\(\%m_{Al}=\dfrac{3,15}{7,5}.100=42\%\)
\(\%m_{Mg}=\dfrac{3,2}{7,5}.100=42,67\%\)