Cho một mẩu sắt tác dụng vủa đủ 200ml dung dịch axit H2SO4, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 ở đktc.
a/ Tính khối lượng sắt đã dùng.
b/ Tính nồng độ mol của dung dịch H2SO4 đã dùng.
c/ Tính nồng độ mol của dung dịch muối thu được. Biết thể tích dung dịch thay đổi không đáng kể.

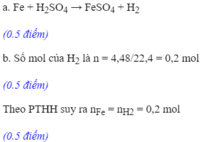

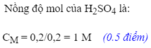

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(C_{M_{FeSO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
PTHH: Fe + H₂SO₄ --> FeSO₄ + H₂
200ml = 0,2 lít.
a) Số mol H₂: nH₂ = 6,72 ÷ 22,4 = 0,3 mol
Theo PTHH => Số mol Fe: nFe = 0,3 mol
=> Khối lượng Fe: mFe = 16,8g
b) Số mol H₂SO₄: nH₂SO₄ = 0,3 mol
Nồng độ mol dd: CM = 0,3 ÷ 0,2 = 1,5M