Nhiệt phân hoàn toàn 24,5 game KClO3( có xúc tác MnO2) sau phản ứng thấy thoát ra V( lít) khí oxi( đktc)
a.Viết phương trình hóa học của phản ứng trên và tính giá trị của V?
b.Để đốt cháy hoàn toàn 11.52 gam kim loại R( có hóa trị không đổi) cần dùng 80% lượng oxi sinh ra từ phản ứng trên. Hãy xác định kim loại R.

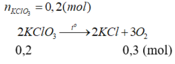

a, \(2KClO_3\underrightarrow{^{t^o,MnO_2}}2KCl+3O_2\)
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,3\left(mol\right)\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{O_2}=0,3.80\%=0,24\left(mol\right)\)
Giả sử R có hóa trị n không đổi.
PT: \(4R+nO_2\underrightarrow{t^o}2R_2O_n\)
Theo PT: \(n_R=\dfrac{4}{n}n_{O_2}=\dfrac{0,96}{n}\left(mol\right)\Rightarrow M_R=\dfrac{11,52}{\dfrac{0,96}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MR = 24 (g/mol) là thỏa mãn.
Vậy: R là Mg.