Một hỗn hợp Y có khối lượng m gam gồm 3 kim loại Mg, Zn, Fe biết tỷ lệ số mol của Mg, Zn, Fe trong hỗn hợp Y lần lượt là 1 : 2 : 3 . Cho hỗn hợp Y vào dung dịch HCl dư đến phản ứng xảy ra hoàn toàn thấy khối lượng dung dịch HCl tăng thêm (m - 2,4) gam. Tính giá trị của m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{H_2} = m -(m-2,4) = 2,4(gam)\\ \Rightarrow n_{H_2} = \dfrac{2,4}{2} = 1,2(mol)\\ Gọi : n_{Mg} = a ;n_{Zn} = 2a;n_{Fe}= 3a(mol)\\ Mg + 2HCl \to MgCl_2 + H_2\\ Zn + 2HCl \to ZnCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Mg} + n_{Zn} + n_{Fe} = a + 2a + 3a = 1,2(mol)\\ \Rightarrow a = 0,2;\\ \Rightarrow m = 0,2.24 + 0,2.2.65 + 0,2.3.56 = 64,4(gam)\)
Bạn ơi, kết quả này có chắc là đúng ko? mik có tìm trên gg r mà nó ra kết quả khác

Gọi x, 2x, 3x tương ứng là số mol của Mg, Zn và Fe: 24x + 65.2x + 56.3x = m ---> m = 322x.
Khối lượng dd tăng = khối lượng kim loại - mH2
m - 2,4 = m - (2x + 4x + 9x) ---> 15x = 2,4 hay x = 0,16 mol.
Thay vào trên thu được: m = 322.0,16 = 51,52 gam.
m - 2,4 = m - (2x + 4x + 9x) ---> 15x = 2,4 hay x = 0,16 mol.
Đoạn này mk chưa hiểu lắm
Giảng lại hộ mk vs

Giả sử hỗn hợp chỉ chứa : Mg
\(n_{Mg}=\dfrac{6.5}{24}=0.27\left(mol\right)\)
\(n_{HCl}=0.3\cdot2=0.6\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.27.........0.54\)
\(n_{HCl}=0.54< 0.6\)
=> A tan hết .
\(2.\)
\(n_{Fe}=n_{Mg}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(n_{hh}=2a+b=0.15\left(mol\right)\)
\(m_{hh}=80a+65b=6.5\left(g\right)\)
\(\Rightarrow a=0.065,b=0.02\)
\(\%Fe=\dfrac{0.065\cdot56}{6.5}\cdot100\%=56\%\)
\(\%Mg=\dfrac{0.065\cdot24}{6.5}\cdot100\%=24\%\)
\(\%Zn=20\)

Đáp án : C
Chất rắn sau phản ứng gồm 2 kim loại => chắc chắn là Cu và Fe
Hỗn hợp muối sau phản ứng gồm x mol MgCl2 và y mol FeCl2
Bảo toàn Cl : 2x + 2y = 2nCuCl2 + nHCl = 1,6 mol
Bảo toàn khối lượng : m + mCuCl2 + mHCl = m + mmuối + mH2 ( nH2 = ½ nHCl)
=> mmuối = 95x + 127y = 82,4g
=> x = 0,6 ; y = 0,2
=> mMg = 14,4g


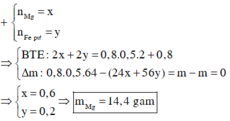



Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=2a\left(mol\right)\\n_{Fe}=3a\left(mol\right)\end{matrix}\right.\)
Ta có: \(m_{t\text{ăng}}=m_{KL}-m_{H_2}\)
\(\Rightarrow m-m_{H_2}=m-2,4\\ \Leftrightarrow m_{H_2}=2,4\left(g\right)\Rightarrow n_{H_2}=\dfrac{2,4}{2}=1,2\left(mol\right)\)
PTHH:
`Mg + 2HCl -> MgCl_2 + H_2`
`Zn + 2HCl -> ZnCl_2 + H_2`
`Fe + 2HCl -> FeCl_2 + H_2`
Theo PTHH:
\(n_{H_2}=n_{Mg}+n_{Zn}+n_{Fe}=a+2a+3a=6a\left(mol\right)\\ \Rightarrow6a=1,2\Leftrightarrow a=0,2\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Zn}=0,2.2=0,4\left(mol\right)\\n_{Fe}=0,2.3=0,6\left(mol\right)\end{matrix}\right.\)
Vậy \(m=0,2.24+0,4.65+0,6.56=64,4\left(g\right)\)